
Wetenschap
Nieuwe studie onthult mechanisme voor hoe ziekteverspreidende prionen van de ene soort naar de andere kunnen springen
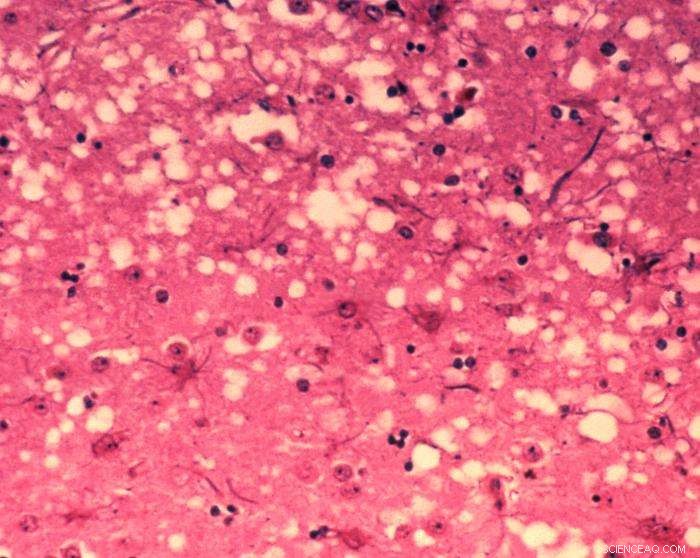
Deze microfoto van hersenweefsel onthult de cytoarchitecturale histopathologische veranderingen die worden gevonden bij boviene spongiforme encefalopathie. De aanwezigheid van vacuolen, oftewel microscopisch kleine "gaatjes" in de grijze stof, geeft de hersenen van door BSE aangetaste koeien een sponsachtig uiterlijk wanneer weefselsecties in het laboratorium worden onderzocht. Credit:Dr. Al Jenny - Public Health Image Library, APHIS:Publiek domein
In een nieuwe studie hebben onderzoekers van de Case Western Reserve University School of Medicine de structuur van eiwitfibrillen geïdentificeerd die verband houden met een erfelijke vorm van menselijke prionziekte. Dit inzicht, zeggen ze, onthult het mechanisme voor hoe prionen tussen sommige diersoorten kunnen springen, terwijl ze een overdraagbaarheidsbarrière tussen andere soorten behouden.
Hoewel hun bevindingen geen onmiddellijke implicaties hebben voor de ontwikkeling van nieuwe therapieën voor meer algemene menselijke prionaandoeningen zoals de ziekte van Creutzfeldt-Jakob, suggereert het werk dat het potentieel voor overdracht van ziekten van de ene soort naar de andere kan worden voorspeld op basis van structurele informatie.
"Een van de belangrijkste resterende vragen op het gebied van prionziekten is waarom deze ziekten tussen sommige diersoorten kunnen worden overgedragen, maar niet tussen andere", zegt Witold Surewicz, een professor in de afdeling Fysiologie en Biofysica aan de School of Medicine en het onderzoek van de studie. senior auteur. "Onze bevindingen verklaren hoe dit werkt."
De studie is gepubliceerd in Nature Structural &Molecular Biology . Qiuye Li, een postdoctoraal onderzoeker aan de School of Medicine, was hoofdauteur. De studie was co-auteur van Christopher Jaroniec, een professor in chemie en biochemie aan de Ohio State University.
Prionziekten, ook bekend als "overdraagbare spongiforme encefalopathieën", zijn een groep besmettelijke hersenverspillende aandoeningen, waaronder de ziekte van Creuzfeldt-Jakob bij mensen, boviene spongiforme encefalopathie (gekkekoeienziekte) bij runderen en chronische slopende ziekte bij herten en elanden.
Deze dodelijke aandoeningen zijn uniek vanwege hun infectieuze ziekteverwekker, die geen virus is maar een abnormaal gevormde vorm van het prion-eiwit.
Dit misvormde eiwit assembleert zich tot lange fibrillen die zich verspreiden door te werken als een sjabloon - of "zaad" - dat zich bindt aan normaal prion-eiwit en het dwingt van vorm te veranderen in een abnormale, ziekteverwekkende vorm, zei Surewicz.
Hoewel abnormaal gevormde eiwitten gemakkelijk kunnen fungeren als sjablonen om normale prion-eiwitten van dezelfde soort om te zetten, wordt aangenomen dat cross-seeding beperkt is vanwege soortafhankelijke verschillen in de volgorde van aminozuren - de basisbouwstenen van elk eiwit.
"Het lijkt erop dat de barrières - of het ontbreken daarvan - volledig worden bepaald door het vermogen van prioneiwit van de ene soort om de structuur van prionfibrilzaden van een andere soort over te nemen," zei Li. "Dit hangt op zijn beurt af van verschillen in aminozuur op belangrijke structuurbepalende posities."
Eerder ontwikkelden wetenschappers in het Surewicz-laboratorium een model dat gebruikmaakte van een afgeknotte vorm van prioneiwitten waarmee ze in de reageerbuis de mechanismen van prionvermeerdering konden bestuderen, inclusief het fenomeen van overdraagbaarheids- (zaai-) barrières.
Het volledige begrip van deze mechanismen werd echter belemmerd door het gebrek aan informatie over de structuur van infectieuze fibrillen die door deze eiwitten worden gevormd.
De auteurs hebben deze fundamentele beperking overwonnen door gebruik te maken van een techniek van cryo-elektronenmicroscopie - een type microscopie waarbij beelden bij zeer lage temperatuur worden verzameld.
Door in de computer duizenden afbeeldingen te analyseren van fibrillen gevormd door prioneiwitten van mens en muis, bepaalden ze de architectuur van deze fibrillen met een resolutie die dicht bij individuele atomen ligt. Dit structurele inzicht stelde de onderzoekers in staat om, in precieze structurele termen, uit te leggen waarom er barrières zijn voor de doorlaatbaarheid van prionen tussen sommige soorten, terwijl dergelijke barrières niet worden waargenomen tussen andere soorten.
"Hoewel onze huidige studies werden uitgevoerd met behulp van een modelsysteem," zei Surewicz, "heeft het vermogen om prionoverdraagbaarheidsbarrières te rationaliseren en te voorspellen op basis van structurele gegevens belangrijke praktische implicaties, vooral gezien de huidige epidemie van chronisch verspillende ziekten onder elanden en herten in delen van de Verenigde Staten en Canada, en groeiende bezorgdheid over mogelijke overdracht van deze ziekte op mensen." + Verder verkennen
Beschadigde eiwitten in beeld:hoe vorm aanleiding geeft tot variaties van dodelijke hersenziekte
 Tumorgrachten overbruggen met krachtige deeltjes voor medicijnafgifte
Tumorgrachten overbruggen met krachtige deeltjes voor medicijnafgifte Het ontsmetten van industrieel plastic afval om de planeet te ontlasten
Het ontsmetten van industrieel plastic afval om de planeet te ontlasten Polymeer afgeleid van materiaal in de schelpen van garnalen kan geneesmiddelen tegen kanker afleveren op tumorplaatsen
Polymeer afgeleid van materiaal in de schelpen van garnalen kan geneesmiddelen tegen kanker afleveren op tumorplaatsen Gebruik van titratie
Gebruik van titratie Video:Waarom limoensap je huid verbrandt in de zon
Video:Waarom limoensap je huid verbrandt in de zon
 Wildvuur legt historische stad in Californië plat terwijl bewoners vlammen ontvluchten
Wildvuur legt historische stad in Californië plat terwijl bewoners vlammen ontvluchten Satellietstudie van landbedekking in het Amazone-regenwoud geeft inzicht in branden in 2019
Satellietstudie van landbedekking in het Amazone-regenwoud geeft inzicht in branden in 2019 NASA vangt orkaan Juliette boven het Socorro-eiland in Mexico
NASA vangt orkaan Juliette boven het Socorro-eiland in Mexico Onderzoekers delen hun perspectief op de belangrijkste elementen van het herstel van de ozonlaag
Onderzoekers delen hun perspectief op de belangrijkste elementen van het herstel van de ozonlaag Japan zet zich schrap voor meer regen na overstromingen aardverschuivingen
Japan zet zich schrap voor meer regen na overstromingen aardverschuivingen
Hoofdlijnen
- Oude scheikunde kan verklaren waarom levende wezens ATP gebruiken als de universele energievaluta
- Kerkuilen blijken geen gehoorverlies te hebben naarmate ze ouder worden
- Wetenschappers creëren op verzoek endocytose door cellen warm te bedraden
- Ambtenaren:walvissen, na een dodelijk jaar, zou kunnen uitsterven
- Hoe bacteriën werken
- Waar worden vezels gefermenteerd in het spijsverteringskanaal van het varken?
- Het verschil tussen prokaryotische en eukaryotische genexpressie
- Soorten redeneren in geometrie
- Hoe beschadigt UV-licht de DNA-streng?
 Films zijn populairder dan ooit, maar stijgende ticketprijzen kunnen veel mensen de bioscoop uitsluiten
Films zijn populairder dan ooit, maar stijgende ticketprijzen kunnen veel mensen de bioscoop uitsluiten Verhardingsnetwerken verbeteren door de toekomst te voorspellen
Verhardingsnetwerken verbeteren door de toekomst te voorspellen Hoe komt zure regen in de watercyclus?
Hoe komt zure regen in de watercyclus?  Veldcursussen vergroten het succes van studenten, ondersteuning van STEM-diversiteitsinspanningen, studie onthult
Veldcursussen vergroten het succes van studenten, ondersteuning van STEM-diversiteitsinspanningen, studie onthult Drone-tests vinden een aantal verhoogde verontreinigende stoffen in de legerfabriek
Drone-tests vinden een aantal verhoogde verontreinigende stoffen in de legerfabriek Artsen en advocaten wonen minder snel in welvarende gebieden als ze uit arbeidersgezinnen komen, zegt onderzoek
Artsen en advocaten wonen minder snel in welvarende gebieden als ze uit arbeidersgezinnen komen, zegt onderzoek  De voordelen van een verbrandingsinstallatie voor vast afval
De voordelen van een verbrandingsinstallatie voor vast afval  Onderzoekers ontdekken kosteneffectieve methode om schaliegas te vinden
Onderzoekers ontdekken kosteneffectieve methode om schaliegas te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






