Wetenschap
Wetenschappers krijgen een nieuw inzicht in het herstelproces van nucleotide-excisie
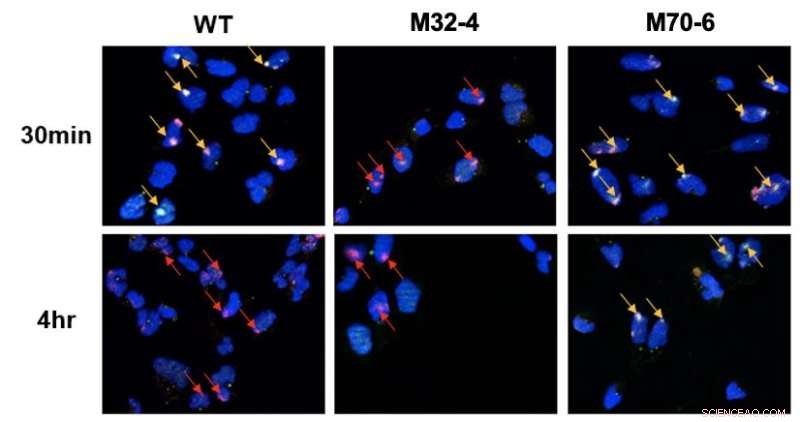
Duidelijke rol van de interacties van RPA32 en RPA70 met XPA in NER. Cellen werden bestraald met UV en de colokalisatie van XPA met UV-beschadigingsplaatsen werd gevisualiseerd door fluorescentiemicroscopie. DNA-schade wordt gemarkeerd door rode pijlen en co-lokalisatie van XPA met UV-DNA wordt aangegeven door gele pijlen. In XPA-RPA32-mutante cellen (M32-4) werd verminderde XPA-rekrutering tot DNA-schade waargenomen. In XPA-RPA70-mutantcellen (M70-6) bleef XPA gedurende langere tijd gebonden op beschadigde plaatsen. Dit geeft aan dat RPA32-interactie met XPA vereist is voor rekrutering van XPA voor door UV veroorzaakte schade, terwijl RPA70-interactie met XPA belangrijk is voor positionering van XPA voor voltooiing van NER. Krediet:Instituut voor Basiswetenschappen
Nucleotide-excisieherstel (NER) is een belangrijk geconserveerd DNA-herstelpad, dat verschillende soorten schade in het genoom herstelt, zoals die veroorzaakt door ultraviolet licht en omgevingsfactoren. Disfunctie in deze route kan schadelijk zijn voor de menselijke gezondheid. Personen met defecten in NER lijden bijvoorbeeld aan xeroderma pigmentosum, een ziekte die wordt gekenmerkt door een extreme aanleg voor door zonlicht veroorzaakte huidkanker als gevolg van een onvermogen om door UV-straling beschadigd DNA te repareren.
Hoewel NER dus kankervorming tegengaat, is het ook belangrijk voor antitumortherapie. Veel antitumormiddelen, zoals cisplatine, veroorzaken schade aan DNA die door NER kan worden gerepareerd. In deze context is NER een interessant doelwit voor geneesmiddelen om de resultaten van kankertherapie te verbeteren. Op moleculair niveau is NER een zeer complexe en dynamische moleculaire machine, waarbij meer dan 30 eiwitten betrokken zijn die zich bij DNA-laesies verzamelen om de schade weg te snijden en te vervangen door intact DNA. Dit proces wordt geleid door eiwit-eiwit- en eiwit-DNA-interacties.
Een team van onderzoekers onder leiding van de Associate Director Orlando D. Schärer en afgestudeerde student Kim Mihyun van het Center for Genomic Integrity binnen het Institute for Basic Science, Zuid-Korea, hebben deze interacties onderzocht. Het team ontdekte dat twee belangrijke eiwitten in NER, namelijk xeroderma pigmentosum eiwit A (XPA) en replicatie eiwit A (RPA) eiwitten, nodig zijn voor het organiseren van het pre-incisiecomplex in NER.
De twee eiwitten XPA en RPA zijn verantwoordelijk voor de organisatie van het NER-complex nadat het de schade in het DNA heeft gevonden. De huidige studie vergeleek mutante varianten van deze twee eiwitten om te onderzoeken hoe de twee eiwitten een cruciale interactie aangaan voor de NER-route. In het bijzonder werd ontdekt dat twee interactie-interfaces tussen XPA en RPA van cruciaal belang zijn voor NER en verschillende rollen in de route hebben. De interactie van XPA met RPA32 is cruciaal voor de initiële associatie van XPA met DNA-schade, terwijl de interactie tussen XPA en RPA70 belangrijk is voor de voltooiing van NER.
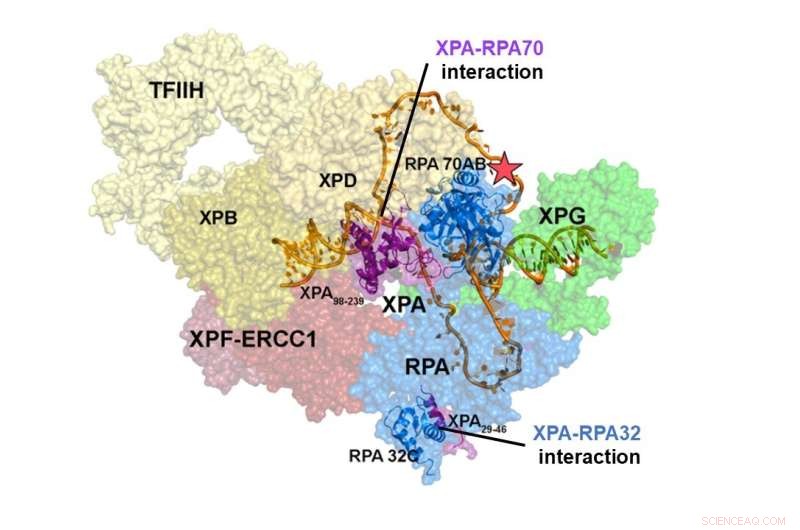
Structuur van het NER-pre-incisiecomplex. De interactie van XPA en RPA70 is gelokaliseerd in het centrum van het NER-complex, terwijl de interactieplaats van XPA en RPA32 zich aan de periferie bevindt. De interacties tussen XPA en RPA70 stabiliseren het pre-incisiecomplex en vernauwen het DNA om een U-vorm aan te nemen, wat de actieve vorm van het complex lijkt te zijn, waardoor het de DNA-schade kan verwijderen. Krediet:Instituut voor Basiswetenschappen
Integratieve structurele studies van een XPA-RPA-DNA-complex onthulden hoe de interacties van de twee eiwitten het NER-complex vormen en excisie van de schade veroorzaken. De interactie van XPA en RPA32 vindt plaats aan de periferie van het complex, waar het de initiële assemblage van de eiwitten op de plaats van beschadiging vergemakkelijkt. De interactie tussen XPA en RPA70 bevindt zich in het hart van het NER-complex en dwingt het DNA in een U-vorm. Hierdoor kunnen de twee ss/dsDNA-juncties dicht bij elkaar worden gelokaliseerd, waardoor het NER-complex het DNA kan insnijden om de schade te verwijderen.
Schärer verklaarde dat hun "onderzoek een verrassend nieuw model van het NER-complex onthulde en hoe de interactie tussen XPA en RPA de architectuur ervan vormgeeft. Verstoring van de interactie tussen XPA en RPA remt NER, en onze studie biedt een blauwdruk voor hoe deze interactie kan worden gericht op kleine moleculen om kankertherapie te verbeteren. We blijven vervolgonderzoek uitvoeren samen met onze langdurige medewerker aan dit project, prof. Walter Chazin van de Vanderbilt University."
Dit onderzoek is gepubliceerd in Proceedings of the National Academy of Sciences . + Verder verkennen
Moleculaire tags onthullen hoe beschadigde lysosomen worden geselecteerd en gemarkeerd voor verwijdering
 Ontwikkeling van een vast materiaal dat langzaam waterstofsulfide en stikstofmonoxide kan afgeven
Ontwikkeling van een vast materiaal dat langzaam waterstofsulfide en stikstofmonoxide kan afgeven Wat is Gibbs vrije energie?
Wat is Gibbs vrije energie?  Marshmallow-achtige siliconengels gebruikt als isolatie in containers voor gecryopreserveerde embryo's
Marshmallow-achtige siliconengels gebruikt als isolatie in containers voor gecryopreserveerde embryo's Fotosynthese versus cellulaire ademhaling in elektronenstroom
Fotosynthese versus cellulaire ademhaling in elektronenstroom Nobelprijswinnende techniek zoals Google Earth voor moleculen
Nobelprijswinnende techniek zoals Google Earth voor moleculen
 Team publiceert nieuwe gegevens over de geschiedenis van de Pacific Ring of Fire
Team publiceert nieuwe gegevens over de geschiedenis van de Pacific Ring of Fire Nieuw inzicht in rivierstromen en sedimenttransport onder ijsbedekking
Nieuw inzicht in rivierstromen en sedimenttransport onder ijsbedekking Rapport:Bosbranden bedreigen de vooruitgang van Californië bij het terugdringen van broeikasgassen
Rapport:Bosbranden bedreigen de vooruitgang van Californië bij het terugdringen van broeikasgassen Michigans suiker esdoorns zullen worstelen in een warmer, drogere toekomst ondanks hulp van stikstofvervuiling
Michigans suiker esdoorns zullen worstelen in een warmer, drogere toekomst ondanks hulp van stikstofvervuiling De gevolgen van de klimaatverandering zijn al opgesloten, maar het ergste kan nog worden vermeden
De gevolgen van de klimaatverandering zijn al opgesloten, maar het ergste kan nog worden vermeden
Hoofdlijnen
- Onderzoeksteam kijkt naar het verleden voor inzichten over de toekomst van megafauna
- De natuur laat zien hoe bacteriën lignine afbreken en geeft beter inzicht om biobrandstoffen te maken
- Denk je dat je een hersenschudding hebt? Een bloedtest kan het diagnosticeren
- Een RNA TREAT voor Halloween
- Moeite met onthouden? Vertel je vrienden om een wandeling te maken
- Angst voor haaien beïnvloedt zeewiergroei op Fijische koraalriffen
- Wat zijn de functies van koolhydraten in planten en dieren?
- Chemische vingerafdrukken gebruiken om fraude met zeevruchten en illegale visserij te bestrijden
- Wat is een Mordant in de microbiologie?
 Deuteratie van moleculen met behulp van enzymen
Deuteratie van moleculen met behulp van enzymen De borstelharen van polyelektrolytborstels opfleuren en krimpen
De borstelharen van polyelektrolytborstels opfleuren en krimpen Groenere moleculaire tussenproducten kunnen helpen bij het ontwerpen van medicijnen
Groenere moleculaire tussenproducten kunnen helpen bij het ontwerpen van medicijnen Zal het coronavirus mobiele betalingssystemen zoals Apple Pay, Google Pay mainstream?
Zal het coronavirus mobiele betalingssystemen zoals Apple Pay, Google Pay mainstream? Welke nieuwe emoji's komen eraan?
Welke nieuwe emoji's komen eraan? Nieuwe natuurkunde ontsnapt ons charmant
Nieuwe natuurkunde ontsnapt ons charmant Onderzoekers meten het kielzog van supersonische projectielen
Onderzoekers meten het kielzog van supersonische projectielen Donkere materie opsporen
Donkere materie opsporen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com