
Wetenschap
Twee nieuwe ontdekkingen werpen licht op het mysterie van hoe cellen omgaan met stress
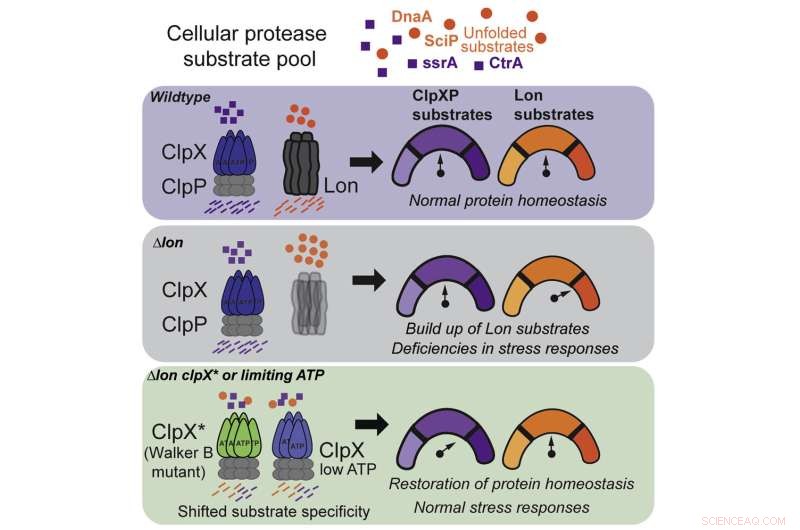
Krediet:Samar A. Mahmoud et al, Cell Reports (2022). DOI:10.1016/j.celrep.2022.111405
In nieuw onderzoek dat onlangs is gepubliceerd in het tijdschrift Cell Reports , een team van wetenschappers van de Universiteit van Massachusetts Amherst in de mysteries van hoe cellen stress doorstaan. Met behulp van bacteriële cellen ontdekten de onderzoekers dat een schadehersteld enzym, ClpX genaamd, niet alleen kan muteren om meerdere cellulaire problemen op te lossen, maar ook kan reageren op veranderende niveaus van cellulaire energie om een cel gezond te houden.
"Waar we echt in geïnteresseerd zijn", zegt Peter Chien, hoogleraar biochemie en moleculaire biologie aan UMass Amherst en senior auteur van het artikel, "is hoe cellen reageren op stress. We bestuderen een klasse enzymen, proteasen genaamd, die zich richten op en vernietigen schadelijke eiwitten in een cel. Deze proteasen kunnen selectief specifieke, individuele eiwitten enkelvoudige eiwitten herkennen. Maar hoe doen ze dit? Hoe kunnen ze kiezen tussen gezonde en schadelijke eiwitten?"
Om deze vraag te beantwoorden, concentreerden Chien en zijn co-auteurs zich op twee specifieke proteasen, bekend als Lon en ClpX, die elk voortreffelijk zijn afgestemd om een ander schadelijk eiwit te herkennen. Lange tijd werd gedacht dat Lon en ClpX als sleutels functioneerden:elk kon slechts een specifiek slot openen en geen ander, en als een cel geen van beide had, zouden er ernstige bijwerkingen optreden.
"Als je ooit een extreem rommelige kamergenoot op de universiteit hebt gehad", zegt Chien, "weet je hoe belangrijk het is om de prullenbak regelmatig te legen. Het missen van de Lon-protease is alsof je een kamergenoot hebt die zich nooit wast, verandert of schoonmaakt."
Maar na een reeks experimenten waarbij Lon uit kolonies van bacteriecellen werd verwijderd, begon het team van Chien iets vreemds op te merken:sommige kolonies overleefden.
Deze observatie leidde tot hun eerste ontdekking:ClpX kan muteren om een Lon-achtige functie uit te voeren, hoewel het enkele van zijn ClpX-mogelijkheden verliest. Het is alsof je, om je slaapzaal schoon te houden, de sokken van je kamergenoot begon te wassen, maar daarvoor wat van je eigen schone was moest opofferen.
Door precies te achterhalen hoe de ClpX-mutatie de protease in staat stelde zijn functie uit te breiden, deed het team zijn tweede ontdekking:wilde, niet-mutante ClpX kan ook enkele van Lons taken uitvoeren, onder de juiste omstandigheden.
Het blijkt dat ClpX zeer gevoelig is voor ATP, een organische verbinding die de energiebron is voor alle levende cellen. Bij normale ATP-niveaus concentreert ClpX zich op zijn eigen taken, maar bij een bepaalde, lagere drempel begint het plotseling op te ruimen na Lon.
"Dit is een echte doorbraak in het basisbegrip van hoe cellen werken", zegt Chien. "Het verandert de regels:cellulaire energie bepaalt niet alleen hoe snel een cel werkt, maar ook hoe het werkt." + Verder verkennen
ClpX-ClpP eiwitcomplex kan startpunt zijn voor nieuwe antibiotica
 Hybridisatie berekenen
Hybridisatie berekenen Nieuwe 3D-printtechniek produceert levende 4D-materialen
Nieuwe 3D-printtechniek produceert levende 4D-materialen Waarom zijn er buffers in fermentatie?
Waarom zijn er buffers in fermentatie?
Mensen gebruiken ethanol sinds hun prehistorie in wijn, bier en andere alcoholische dranken als een recreatieve drug. Meer recentelijk is ethanol ook belangrijk geworden als alternatieve brandstof. Of het nu v
 De route voor de productie van ethyleen
De route voor de productie van ethyleen Hoe de straal van een atoom berekenen
Hoe de straal van een atoom berekenen
 We kunnen wolken helderder maken om warmte te weerkaatsen en de opwarming van de aarde te verminderen. Maar moeten we?
We kunnen wolken helderder maken om warmte te weerkaatsen en de opwarming van de aarde te verminderen. Maar moeten we? Antarctisch zee-ijs krimpt voor tweede jaar op rij
Antarctisch zee-ijs krimpt voor tweede jaar op rij Gecontroleerde brandwonden beperkte ernst van Rim Fire, onderzoekers vinden
Gecontroleerde brandwonden beperkte ernst van Rim Fire, onderzoekers vinden Uit onderzoek blijkt dat boeren in Pennsylvania veel hebben gedaan om de waterkwaliteit van Chesapeake Bay te beschermen
Uit onderzoek blijkt dat boeren in Pennsylvania veel hebben gedaan om de waterkwaliteit van Chesapeake Bay te beschermen Hoe zorgen hogere golven voor meer ijswolken? Onderzoeksexpeditie in de arctische zee legt uit
Hoe zorgen hogere golven voor meer ijswolken? Onderzoeksexpeditie in de arctische zee legt uit
Hoofdlijnen
- Genomics-onderzoek identificeert een unieke set eiwitten die het gehoor bij zebravissen herstellen
- Onthullingen van 17 miljoen jaar oude apentanden kunnen leiden tot nieuwe inzichten over de vroege menselijke evolutie
- Een eenvoudig diercelmodel maken
- Voorbeelden van genetische diversiteit
- Onderzoeker bespreekt de biologische overspraak tussen microben en gastheren
- Zijn kinderen gelukkiger dan volwassenen?
- Louis Pasteur: Biografie, uitvindingen, experimenten en feiten
- Wetenschappers ontwerpen nieuwe moleculen die resistentie tegen conventionele antibiotica kunnen overwinnen
- Vrijgen van genetische parasieten kan leiden tot nieuwe verdediging tegen gevaarlijke bacteriën
- Cameravallen en andere goedkope gegevensbronnen vormen de basis voor ecologiestudies en inspanningen voor natuurbehoud

- Monarchvlinders getagd met stickers in de tuin van Chicago terwijl ze naar het zuiden trekken

- Chromatid: wat is het?

- Begrijpen? Je hersensignalen zullen het vertellen

- Hoe antibioticagebruik bij dieren bijdraagt aan antibioticaresistentie

 Naarmate de luchtvervuiling in sommige Amerikaanse steden toeneemt, de regering-Trump verzwakt de regels voor schone lucht
Naarmate de luchtvervuiling in sommige Amerikaanse steden toeneemt, de regering-Trump verzwakt de regels voor schone lucht Het detecteren van kosmische straling van een sterrenstelsel ver, ver weg
Het detecteren van kosmische straling van een sterrenstelsel ver, ver weg Experimentele natuurkundigen bestuderen staal aan boord van het ISS
Experimentele natuurkundigen bestuderen staal aan boord van het ISS De lange-kantmaat vinden op een rechter driehoek
De lange-kantmaat vinden op een rechter driehoek Onderzoekers onthullen nieuwe, stabiele 2D-materialen
Onderzoekers onthullen nieuwe, stabiele 2D-materialen Buzz Aldrin krijgt bezoek van NASA na poolevacuatie
Buzz Aldrin krijgt bezoek van NASA na poolevacuatie Wiskundigen lossen een oud meetkundig probleem op op gelijkhoekige lijnen
Wiskundigen lossen een oud meetkundig probleem op op gelijkhoekige lijnen Taiwans nieuwe luchtvaartmaatschappij StarLux tekent deal met Airbus voor 17 vliegtuigen
Taiwans nieuwe luchtvaartmaatschappij StarLux tekent deal met Airbus voor 17 vliegtuigen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

