Wetenschap
Nieuwe intermoleculaire oppervlaktekracht onthult actomyosine-aandrijfmechanisme
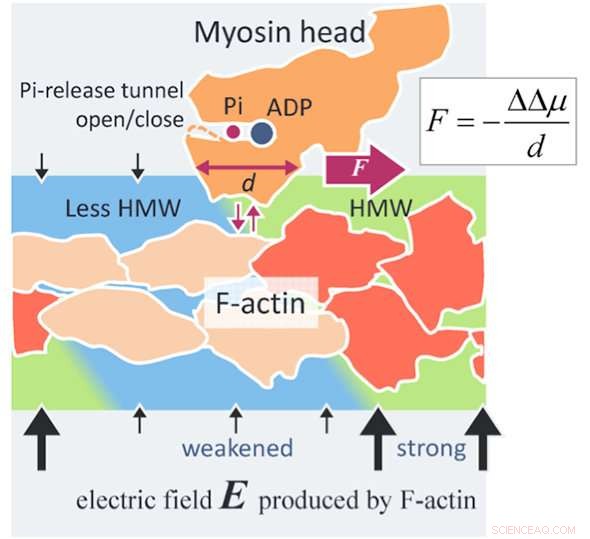
Een nieuw krachtgeneratiemechanisme van actomyosine. Een actinefilament (F-actine) produceert een elektrisch veld (zwarte pijlen) zo hoog als 100 MV/m rond F-actine vanwege de negatieve oppervlakteladingen. De watermoleculen in zo'n hoog elektrisch veld worden hypermobiele watermoleculen (HMW, lichtgroen) in de buurt van F-actine. Anderzijds, ATP in oplossing bindt met een myosinekop (oranje) en wordt in de kop gesplitst in adenosinedifosfaat (ADP) en anorganisch fosfaat (Pi). Wanneer de myosinekop met ADP en Pi bindt met F-actine (oranjerood), verschillende actine-subeenheden veranderen hun structuur (beige). Dan neemt de elektrische veldsterkte rond deze veranderde actine-subeenheden af en neemt ook de HMW-intensiteit af (lichtblauw) om dicht bij vrij water te komen. In de huidige studie, de eiwithydratatietoestand is stabieler gebleken in het sterkere HMW-gebied. In de figuur, de myosinekop wordt naar rechts gedreven waar de HMW-intensiteit sterker is (lichtgroen), met losmaken van F-actine en opnieuw hechten met F-actine. De kracht geëvalueerd door de huidige methode is zo hoog als enkele piconewtons, wat op het niveau van de experimentele waarden ligt. Dit kan een principe zijn van een nieuwe oppervlaktekracht die werkt tussen een geladen macromolecuul, zoals eiwitten en DNA, en een opgelost eiwit dat breed toepasbaar is op wetenschap en technologie. Krediet:Makoto Suzuki
Het actine- en myosinecomplex (actomyosine) genereert contractiekracht van een spier met behulp van de hydrolysereactie van adenosinetrifosfaat (ATP). Er zijn dus veel pogingen gedaan om de moleculaire oorsprong van de actomyosine-motiliteit te verklaren.
Een myosine-krachtslagmodel, voorgesteld door Huxley en Simmons in 1971, initieerde veel onderzoek, waaronder atomaire structuurstudies en het onderzoek naar de moleculaire biologie van myosine- en actine-moleculen. Het krachtslagmodel, de laatste tijd gewijzigd, wordt algemeen overgenomen in standaard biologieboeken.
Echter, er blijft een serieus probleem. Volgens de experimentele thermodynamische gegevens, de ATP-hydrolyse in de myosinekop produceert geen myosinetoestand met voldoende energie om de contractiekracht te genereren.
Nutsvoorzieningen, een onderzoeksgroep, onder leiding van emeritus professor Makoto Suzuki aan de Tohoku University in samenwerking met professor Nobuyuki Matubayasi aan de Osaka University, is erin geslaagd het actomyosine-aandrijfmechanisme te verklaren volgens de experimentele thermodynamische gegevens.
In de studie, de waterstructuur in de nabijheid van een actinefilament (F-actine) wordt gemodificeerd na binding met een myosinekop die ATP hydrolyseert tot F-actine, dat leidt tot een verandering in de affiniteit met de myosinekop en dus tot het genereren van de drijvende kracht van actomyosine.
De aanwezigheid van de nieuwe intermoleculaire oppervlaktekracht - die voor het eerst werd aangetoond op basis van de huidige hydratatieanalyses - was een opvallende ontdekking. Dit artikel is, daarom, de eerste die met succes het actomyosine-aandrijfmechanisme onthulde door een nieuwe intermoleculaire oppervlaktekracht te introduceren.
 Moleculaire basis van effecten van medicijnen op de ontwikkeling van ledematen en oren onthuld
Moleculaire basis van effecten van medicijnen op de ontwikkeling van ledematen en oren onthuld Chemici zetten afval van plastic flessen om in sorptiemiddel voor insecten
Chemici zetten afval van plastic flessen om in sorptiemiddel voor insecten Dansende materie:nieuwe vorm van beweging van cyclische macromoleculen ontdekt
Dansende materie:nieuwe vorm van beweging van cyclische macromoleculen ontdekt Geïnspireerd door kombuchathee, ingenieurs creëren levende materialen
Geïnspireerd door kombuchathee, ingenieurs creëren levende materialen Milieuproblemen in de meren van de Adirondack Mountains
Milieuproblemen in de meren van de Adirondack Mountains
 Biologen identificeren oude stressrespons in koralen
Biologen identificeren oude stressrespons in koralen Een prijs zetten op koolstofvervuiling alleen zal waarschijnlijk niet helpen om de klimaatdoelen te bereiken
Een prijs zetten op koolstofvervuiling alleen zal waarschijnlijk niet helpen om de klimaatdoelen te bereiken Burkina Faso-studie toont verband aan tussen landdegradatie en migratie
Burkina Faso-studie toont verband aan tussen landdegradatie en migratie Wetenschappers voorspellen hoeveel plastic dieren kunnen eten
Wetenschappers voorspellen hoeveel plastic dieren kunnen eten Hoe kan door de mens veroorzaakte klimaatverandering worden bewezen?
Hoe kan door de mens veroorzaakte klimaatverandering worden bewezen?
Hoofdlijnen
- Wat zijn de stappen in de meiose die de variabiliteit verhogen?
- Insectencompound Oog versus Menselijk Oog
- Nieuwe technologie verlicht microben die niet in een laboratorium kunnen worden gekweekt
- Wat zijn drie primaire doelen van mitose?
- Welke bijdrage heeft Avery geleverd aan de ontdekking van DNA?
- Het belang van samengestelde microscopen
- Knoflook kan chronische infecties bestrijden
- Haaien evolueerden vliegtuigachtige attributen om in habitats te passen
- Kankerwetenschappers ruiken de genen achter Durians Famous Stink
 Troebelheid converteren naar TSS
Troebelheid converteren naar TSS Grootschalig onderzoek wijst op nieuwe, overvloedige stikstofbindende microben in de oceaan aan de oppervlakte
Grootschalig onderzoek wijst op nieuwe, overvloedige stikstofbindende microben in de oceaan aan de oppervlakte Koper-indiumoxide:een snellere en koelere manier om onze ecologische voetafdruk te verkleinen
Koper-indiumoxide:een snellere en koelere manier om onze ecologische voetafdruk te verkleinen InSight-ingenieurs hebben een rotstuin op Mars gemaakt
InSight-ingenieurs hebben een rotstuin op Mars gemaakt Kleine sondes schijnen helder om de locatie van beoogde weefsels te onthullen
Kleine sondes schijnen helder om de locatie van beoogde weefsels te onthullen Op koolstof gebaseerde nanomaterialen kunnen de kosten van zonne-energie verlagen
Op koolstof gebaseerde nanomaterialen kunnen de kosten van zonne-energie verlagen RNA (ribonucleïnezuur): definitie, functie, structuur
RNA (ribonucleïnezuur): definitie, functie, structuur Hoe kon het 45 dagen achter elkaar regenen?
Hoe kon het 45 dagen achter elkaar regenen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Norway | Italian | Danish |

-
Wetenschap © https://nl.scienceaq.com