
Wetenschap
Een gouden kogel voor kanker:nanodeeltjes zorgen voor een gerichte versie van fotothermische therapie voor kanker

De kleur van een suspensie van nanokooien hangt af van de dikte van de wanden van de kooien en de grootte van de poriën in die wanden. Zoals hun kleur, hun vermogen om licht te absorberen en om te zetten in warmte kan nauwkeurig worden gecontroleerd. Krediet:WUSTL
In een lezing die hij in 1906 hield, de Duitse arts Paul Ehrlich bedacht de term Zuberkugel, of "magische kogel, " als afkorting voor een zeer gerichte medische behandeling.
magische kogels, ook wel zilveren kogels genoemd, vanwege het folkloristische geloof dat alleen zilveren kogels bovennatuurlijke wezens kunnen doden, blijven het doel van de inspanningen voor de ontwikkeling van geneesmiddelen vandaag.
Een team van wetenschappers van de Washington University in St. Louis werkt momenteel aan een wondermiddel voor kanker, een ziekte waarvan de behandelingen notoir willekeurig en niet-specifiek zijn. Maar hun kogels zijn eerder van goud dan van zilver. Letterlijk.
De gouden kogels zijn gouden nanokooien die, wanneer geïnjecteerd, zich selectief ophopen in tumoren. Wanneer de tumoren later worden ondergedompeld in laserlicht, het omringende weefsel wordt nauwelijks opgewarmd, maar de nanokooien zetten licht om in warmte, het doden van de kwaadaardige cellen.
In een artikel dat zojuist in het tijdschrift is gepubliceerd Klein , het team beschrijft de succesvolle fotothermische behandeling van tumoren bij muizen.
Het team bestaat uit Younan Xia, doctoraat, de James M. McKelvey hoogleraar biomedische technologie aan de School of Engineering and Applied Science, Michael J. Welch, doctoraat, hoogleraar radiologie en ontwikkelingsbiologie aan de School of Medicine, Jingyi Chen, doctoraat, onderzoeksassistent-professor biomedische technologie en Charles Glaus, doctoraat, een postdoctoraal onderzoeker bij de afdeling Radiologie.
"We zagen significante veranderingen in tumormetabolisme en histologie, " zegt Welch, "wat opmerkelijk is gezien het feit dat het werk verkennend was, de laser 'dosis' was niet gemaximaliseerd, en de tumoren waren 'passief' in plaats van 'actief' gericht."
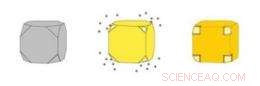
Gouden nanokooien (rechts) zijn holle dozen gemaakt door goud neer te slaan op zilveren nanokubussen (links). Het zilver erodeert tegelijkertijd vanuit de kubus, oplossing binnendringen via poriën die openen in de geknipte hoeken van de kubus. Krediet:WUSTL
Waarom de nanokooien heet worden
De nanokooien zelf zijn ongevaarlijk. "Goudzouten en goudcolloïden worden al meer dan 100 jaar gebruikt om artritis te behandelen, " zegt Welch. "Mensen weten wat goud in het lichaam doet en het is inert, dus we hopen dat dit een niet-toxische aanpak wordt."
"De sleutel tot fotothermische therapie, " zegt Xia, "is het vermogen van de kooien om licht efficiënt te absorberen en om te zetten in warmte."
Suspensies van de gouden nanokooien, die ongeveer even groot zijn als een virusdeeltje, zijn niet altijd geel, zoals men zou verwachten, maar in plaats daarvan kan elke kleur in de regenboog zijn.
Ze zijn gekleurd door iets dat een oppervlakteplasmonresonantie wordt genoemd. Sommige elektronen in het goud zijn niet verankerd aan individuele atomen, maar vormen in plaats daarvan een vrij zwevend elektronengas, Xia legt uit. Licht dat op deze elektronen valt, kan ze ertoe brengen als één geheel te oscilleren. Deze collectieve trilling, het oppervlakteplasmon, kiest een bepaalde golflengte, of kleur, uit het invallende licht, en dit bepaalt de kleur die we zien.
Middeleeuwse ambachtslieden maakten robijnrood glas in lood door goudchloride in gesmolten glas te mengen, a process that left tiny gold particles suspended in the glass, says Xia.
The resonance — and the color — can be tuned over a wide range of wavelengths by altering the thickness of the cages' walls. For biomedical applications, Xia's lab tunes the cages to 800 nanometers, a wavelength that falls in a window of tissue transparency that lies between 750 and 900 nanometers, in the near-infrared part of the spectrum.
Light in this sweet spot can penetrate as deep as several inches in the body (either from the skin or the interior of the gastrointestinal tract or other organ systems).
The conversion of light to heat arises from the same physical effect as the color. The resonance has two parts. At the resonant frequency, light is typically both scattered off the cages and absorbed by them.
By controlling the cages' size, Xia's lab tailors them to achieve maximum absorption.
Passive targeting
"If we put bare nanoparticles into your body, " says Xia, "proteins would deposit on the particles, and they would be captured by the immune system and dragged out of the bloodstream into the liver or spleen."
To prevent this, the lab coated the nanocages with a layer of PEG, a nontoxic chemical most people have encountered in the form of the laxatives GoLyTELY or MiraLAX. PEG resists the adsorption of proteins, in effect disguising the nanoparticles so that the immune system cannot recognize them.
Instead of being swept from the bloodstream, the disguised particles circulate long enough to accumulate in tumors.
A growing tumor must develop its own blood supply to prevent its core from being starved of oxygen and nutrients. But tumor vessels are as aberrant as tumor cells. They have irregular diameters and abnormal branching patterns, but most importantly, they have thin, leaky walls.
The cells that line a tumor's blood vessel, normally packed so tightly they form a waterproof barrier, are disorganized and irregularly shaped, and there are gaps between them.
The nanocages infiltrate through those gaps efficiently enough that they turn the surface of the normally pinkish tumor black.
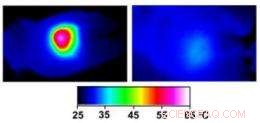
Infrared images made while tumors were irradiated with a laser show that in nanocage-injected mice (left), the surface of the tumor quickly became hot enough to kill cells. In buffer-injected mice (right), the temperature barely budged. This specificity is what makes photothermal therapy so attractive as a cancer therapy. Credit:WUSTL
A trial run
In Welch's lab, mice bearing tumors on both flanks were randomly divided into two groups. The mice in one group were injected with the PEG-coated nanocages and those in the other with buffer solution. Several days later the right tumor of each animal was exposed to a diode laser for 10 minutes.
The team employed several different noninvasive imaging techniques to follow the effects of the therapy. (Welch is head of the oncologic imaging research program at the Siteman Cancer Center of Washington University School of Medicine and Barnes-Jewish Hospital and has worked on imaging agents and techniques for many years.)
During irradiation, thermal images of the mice were made with an infrared camera. As is true of cells in other animals that automatically regulate their body temperature, mouse cells function optimally only if the mouse's body temperature remains between 36.5 and 37.5 degrees Celsius (98 to 101 degrees Fahrenheit).
At temperatures above 42 degrees Celsius (107 degrees Fahrenheit) the cells begin to die as the proteins whose proper functioning maintains them begin to unfold.
In the nanocage-injected mice, the skin surface temperature increased rapidly from 32 degrees Celsius to 54 degrees C (129 degrees F).
In the buffer-injected mice, echter, the surface temperature remained below 37 degrees Celsius (98.6 degrees Fahrenheit).
To see what effect this heating had on the tumors, the mice were injected with a radioactive tracer incorporated in a molecule similar to glucose, the main energy source in the body. Positron emission and computerized tomography (PET and CT) scans were used to record the concentration of the glucose lookalike in body tissues; the higher the glucose uptake, the greater the metabolic activity.
The tumors of nanocage-injected mice were significantly fainter on the PET scans than those of buffer-injected mice, indicating that many tumor cells were no longer functioning.
The tumors in the nanocage-treated mice were later found to have marked histological signs of cellular damage.
Active targeting
The scientists have just received a five-year, $2, 129, 873 grant from the National Cancer Institute to continue their work with photothermal therapy.
Despite their results, Xia is dissatisfied with passive targeting. Although the tumors took up enough gold nanocages to give them a black cast, only 6 percent of the injected particles accumulated at the tumor site.
Xia would like that number to be closer to 40 percent so that fewer particles would have to be injected. He plans to attach tailor-made ligands to the nanocages that recognize and lock onto receptors on the surface of the tumor cells.
In addition to designing nanocages that actively target the tumor cells, the team is considering loading the hollow particles with a cancer-fighting drug, so that the tumor would be attacked on two fronts.
But the important achievement, from the point of view of cancer patients, is that any nanocage treatment would be narrowly targeted and thus avoid the side effects patients dread.
The TV and radio character the Lone Ranger used only silver bullets, allegedly to remind himself that life was precious and not to be lightly thrown away. If he still rode today, he might consider swapping silver for gold.
 Osteoblastisch lysosoom speelt een centrale rol bij mineralisatie
Osteoblastisch lysosoom speelt een centrale rol bij mineralisatie Wetenschappers onthullen aard van geometrische fase-effecten in ultrakoude chemische reacties
Wetenschappers onthullen aard van geometrische fase-effecten in ultrakoude chemische reacties Betere batterijen bouwen door te lenen van biologie
Betere batterijen bouwen door te lenen van biologie Geleidbaarheid vs. Concentratie
Geleidbaarheid vs. Concentratie Onderzoekers onderzoeken energiebesparende katalysatoren die werken bij kamertemperatuur
Onderzoekers onderzoeken energiebesparende katalysatoren die werken bij kamertemperatuur
Hoofdlijnen
- Biologen op het spoor van hersenetende amoeben
- Kan de groei van volwassen hersencellen de manier waarop we denken over veroudering veranderen?
- Wat zijn de belangrijkste functies van Cilia & Flagella?
- De primaire primaire productiviteit berekenen
- 2 Voorbeelden van Heterozygote eigenschappen
- Omgaan met antibiotica niet genoeg om resistentie om te keren
- Is er eerder enige vorm van exploratie op Mercurius gedaan
- Lijst van eencellige organismen
- 5 waargebeurde verhalen over een bij de geboorte gescheiden tweeling
- Op de huid geïnspireerde coating die zo hard is als tanden en zichzelf kan genezen

- Tumordetecterende sensoren om nabehandeling van kanker te verminderen

- Grootste biochemische circuit opgebouwd uit kleine synthetische DNA-moleculen
- Röntgenstralen onthullen opname van nanodeeltjes door sojabonen

- Steenkool levert veel grafeen-kwantumstippen op

 Wiskundig ontworpen grafeen heeft de elektrokatalytische activiteit verbeterd
Wiskundig ontworpen grafeen heeft de elektrokatalytische activiteit verbeterd Appelboomblad Identificatie
Appelboomblad Identificatie Veilig, efficiënte zelfrijdende auto's kunnen beloopbare, leefbare gemeenschappen
Veilig, efficiënte zelfrijdende auto's kunnen beloopbare, leefbare gemeenschappen 5 Gebruik van magneten voor kinderen
5 Gebruik van magneten voor kinderen  Het beheersen van COVID-19 zal verwoestende economische kosten met zich meebrengen voor ontwikkelingslanden
Het beheersen van COVID-19 zal verwoestende economische kosten met zich meebrengen voor ontwikkelingslanden De nadelen van kernenergie
De nadelen van kernenergie  Bewijs van tbc-achtige infectie gevonden bij 245 miljoen jaar oud zeereptiel
Bewijs van tbc-achtige infectie gevonden bij 245 miljoen jaar oud zeereptiel Wanneer de beste stuntwaardige acrobaat een robot is
Wanneer de beste stuntwaardige acrobaat een robot is
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

