
Wetenschap
De cryo-elektronenmicroscopiestructuur van huntingtine
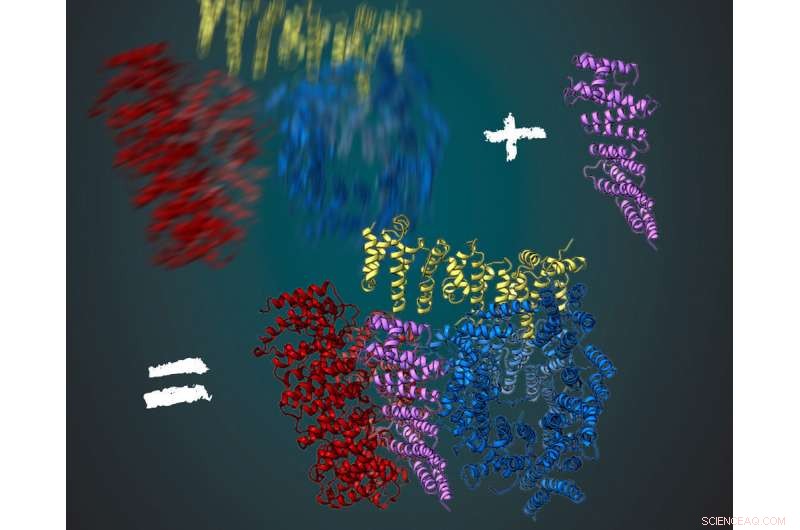
Het eiwit huntingtine bestaat uit drie flexibele regio's, weergegeven in rood, geel en blauw. Samen met zijn interactiepartner HAP40 is (paars) huntingtine stabieler. Hierdoor konden de wetenschappers hun driedimensionale structuur afleiden met behulp van cryo-elektronenmicroscopie. Credit:MPI of Biochemistry/ Illustratie:Gabriele Stautner, ARTIFOX
Mutaties op een enkel gen, het huntingtine-gen, zijn de oorzaak van de ziekte van Huntington. Ze leiden tot een verkeerde vorm van het corresponderende eiwit. Met behulp van cryo-elektronenmicroscopie hebben onderzoekers van het Max Planck Institute of Biochemistry in Martinsried en de Universiteit van Ulm nu de driedimensionale, moleculaire structuur van het gezonde menselijke huntingtine-eiwit. Dit maakt nu de functionele analyse mogelijk. Een beter begrip van de structuur en de functie van het huntingtine-eiwit zou in de toekomst kunnen bijdragen aan de ontwikkeling van nieuwe behandelmethoden.
De ziekte van Huntington begint vaak met emotionele stoornissen en wordt gekenmerkt door onwillekeurige spierbewegingen en verlies van mentale vermogens. Tot vandaag, de neurologische ziekte is een van de erfelijke ziekten die nog steeds ongeneeslijk en dodelijk is. Het eiwit HTT, ook wel huntingtine genoemd, speelt de centrale rol bij de ziekte van Huntington. Al 25 jaar is bekend dat mutaties van het huntingtine-gen, wat de blauwdruk is voor hetzelfde eiwit, de ziekte van Huntington veroorzaken.
Hoewel onderzoekers er jarenlang aan hebben gewerkt, er zijn nog veel hindernissen te overwinnen. Nu Rubén Fernández-Busnadiego van het Max Planck Instituut voor Biochemie en Stefan Kochanek, hoofd van de afdeling Gentherapie van het Universitair Ziekenhuis Ulm, zijn erin geslaagd de moleculaire, driedimensionale structuur van het huntingtine-eiwit.
Stefan Kochanek en zijn team werken al lange tijd aan de productie en zuivering van huntingtine. Wat heeft een gedetailleerde analyse van het eiwit in de afgelopen decennia verhinderd? Fernandez-Busnadiego, een expert in cryo-elektronenmicroscopie, noemt twee belangrijke factoren:"Allereerst, cryo-elektronenmicroscopie is pas de laatste jaren geoptimaliseerd om eiwitstructuren met bijna moleculaire resolutie te bekijken. De tweede reden is dat het huntingtine-eiwit zeer flexibel van structuur is. Net nu, ook voor dit probleem hebben we een oplossing gevonden." Tijdens de analyse, onder de microscoop worden vanuit verschillende perspectieven foto's van het eiwit gemaakt. De driedimensionale moleculaire structuur kan worden berekend uit het grote aantal resulterende afbeeldingen. Voor deze, het eiwit moet altijd in dezelfde conformatie zijn. Fernández-Busnadiego legt uit:"Dit zou vergelijkbaar zijn met een persoon die in het donker wordt gefotografeerd. Als de persoon een tijdje niet stilstaat, het schot zal wazig zijn."
Om een duidelijk beeld te krijgen, de onderzoekers in het Kochanek-lab zijn op zoek gegaan naar andere eiwitten die een interactie aangaan met huntingtine en het stabiliseren. Dat werkte voor het eiwit HAP40. "Huntingtin in verband met HAP40 is gestabiliseerd in een bepaalde conformatie. gemiddeld over veel foto's, konden we de driedimensionale structuur afleiden, " zei Kochanek. "Als we in de analogie van de foto in het donker blijven, dan fungeert het eiwit als een stoel voor de gefotografeerde persoon. erop zitten, de persoon beweegt veel minder en het beeld is veel scherper bij dezelfde belichtingstijd, ", voegt Fernández-Busnadiego toe.
"Hoewel we al enige tijd weten dat de mutatie van het huntingtine-gen ernstige gevolgen heeft, we weten nog relatief weinig over de functie en taken van het gezonde eiwit, " legt Kochanek uit. Eiwitten zijn de moleculaire machines van de cel. Om hun veelzijdige taken te vervullen, ze hebben een bepaalde driedimensionale structuur, vergelijkbaar met een specifiek onderdeel in een machine. "Nu we de exacte structuur van huntingtine kennen, we kunnen verder onderzoeken welke gebieden van huntingtine bijzonder belangrijk zijn en hoe andere eiwitten functioneel samenwerken met huntingtine. Op deze manier kunnen structuren worden afgeleid waarop bepaalde medicijnen therapeutisch kunnen worden gericht."
Direct, er is veel gaande in het onderzoek naar de ziekte van Huntington. Grote hoop is gericht op een methode, die het huntingtine-gen dempt met zogenaamde Antisense-Oligonucleotiden voor de behandeling van de ziekte van Huntington. Deze kleine moleculen verminderen de vorming van huntingtine-eiwitten in de cellen, maar het medicijn kan geen onderscheid maken tussen het normale en het pathologisch veranderde huntingtine-eiwit. Ook om deze reden, het is belangrijk om meer te weten te komen over de functie van het gezonde huntingtine-eiwit. Kochanek kijkt vol vertrouwen naar de toekomst:"De gedecodeerde structuur zal ons een grote stap vooruit brengen".
"De antisense-oligonucleotide-behandelingsproeven worden momenteel alleen in zeer weinig klinieken uitgevoerd. De neurologische universiteitskliniek Ulm leidt de geneesmiddelentests voor Duitsland. Sommige van de momenteel beoordeelde antisense-oligonucleotiden verminderen zowel de vorming van het normale als het mutante huntingtine-eiwit, terwijl anderen voornamelijk proberen het veranderde huntingtine te verlagen. Het is momenteel onduidelijk of een gedeeltelijke remming van de vorming van normaal huntingtine-eiwit nadelen heeft en wordt getolereerd zonder ongewenste bijwerkingen. Dit is nog een reden waarom het belangrijk is om meer te weten te komen over de normale functie van het huntingtine-eiwit. Hiertoe, het onderzoek zal een belangrijke bijdrage leveren, " zegt Bernhard Landwehrmeyer, de directeur van de Huntington-polikliniek van de afdeling Neurologie van het Universitair Medisch Centrum Ulm.
 Gefunctionaliseerde oppervlakken:cilindrische micellaire borstels met op maat gemaakte chemische opties met gecontroleerde lengte
Gefunctionaliseerde oppervlakken:cilindrische micellaire borstels met op maat gemaakte chemische opties met gecontroleerde lengte Nieuwe stoffen met antivirale eigenschappen
Nieuwe stoffen met antivirale eigenschappen Onderzoekers bereiken doorbraak in proces om waterstofbrandstof te produceren
Onderzoekers bereiken doorbraak in proces om waterstofbrandstof te produceren Natuurkundigen meten moleculaire elektronische eigenschappen van vitamines
Natuurkundigen meten moleculaire elektronische eigenschappen van vitamines Exciplex-emissie waargenomen over veel langere afstanden dan eerder voor mogelijk werd gehouden
Exciplex-emissie waargenomen over veel langere afstanden dan eerder voor mogelijk werd gehouden
 De nieuwste duurzaamheidsdoelstellingen van de VN doen meer kwaad dan goed voor het milieu, wetenschappers waarschuwen
De nieuwste duurzaamheidsdoelstellingen van de VN doen meer kwaad dan goed voor het milieu, wetenschappers waarschuwen Klimaatverandering brengt nieuw risico met zich mee:zijn binnenvaartbruggen te laag?
Klimaatverandering brengt nieuw risico met zich mee:zijn binnenvaartbruggen te laag? wereldwijd, overstromingen lijken af te nemen, zelfs als extreme regenval toeneemt. Waarom?
wereldwijd, overstromingen lijken af te nemen, zelfs als extreme regenval toeneemt. Waarom? Vulkaan Indonesië braakt enorme askolom uit
Vulkaan Indonesië braakt enorme askolom uit Organismen in het Koninkrijk Monera
Organismen in het Koninkrijk Monera
Hoofdlijnen
- Parasitaire ooginfectie vormt een aanzienlijke bedreiging voor Britse honden, waarschuw experts
- Neushoornstroper krijgt 20 jaar cel in Zuid-Afrika
- Een bacterieel stroomdiagram maken
- De methoden van inventarisatie in Microbes
- Hoe zijn bacteriën en plantencellen gelijk?
- Behoefte aan snelheid maakt genoombewerking efficiënt, zo niet beter
- Prehistorische skeletten van vrouwen tonen impact van rigoureuze handenarbeid
- Hoe zijn fotosynthese en cellulaire ademhaling gerelateerd?
- Duurzame zeevruchten bovenaan het menu voor nieuwe onderzoeksgroep
- Rubber maken met maïszetmeel, water en azijn

- In lijn:het eenvoudige ontwerp en de controle van MOF elektrische stroom

- Mmol

- Computerwetenschappers en materiaalonderzoekers werken samen om staalclassificatie te optimaliseren

- Ongebruikelijk halfmetaal vertoont bewijs van unieke toestanden van oppervlaktegeleiding

 Hoe kunnen we elektronische apparaten ontwerpen die niet oververhitten?
Hoe kunnen we elektronische apparaten ontwerpen die niet oververhitten? Bij het rapporteren van klimaatgedreven menselijke migratie, plaats zaken
Bij het rapporteren van klimaatgedreven menselijke migratie, plaats zaken Franse Renault-werknemers onaangedaan als CEO Ghosn wordt berecht in Japan
Franse Renault-werknemers onaangedaan als CEO Ghosn wordt berecht in Japan Hoe evolueert de mens?
Hoe evolueert de mens?  Wil je iets doen aan klimaatverandering, maar weet je niet hoe? Het aanpassen van deze 3 delen van je leven zal het grootste verschil maken
Wil je iets doen aan klimaatverandering, maar weet je niet hoe? Het aanpassen van deze 3 delen van je leven zal het grootste verschil maken Brandstichters Portugal voeden natuurbrandvernietiging
Brandstichters Portugal voeden natuurbrandvernietiging Grafeen schildert een corrosievrije toekomst
Grafeen schildert een corrosievrije toekomst Artefacten blootgelegd door orkaan Maria leiden tot archeologische ontdekking
Artefacten blootgelegd door orkaan Maria leiden tot archeologische ontdekking
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

