
Wetenschap
Een nieuw gen bij zoogdieren dat een nieuwe structuur in zenuwcellen aanstuurt
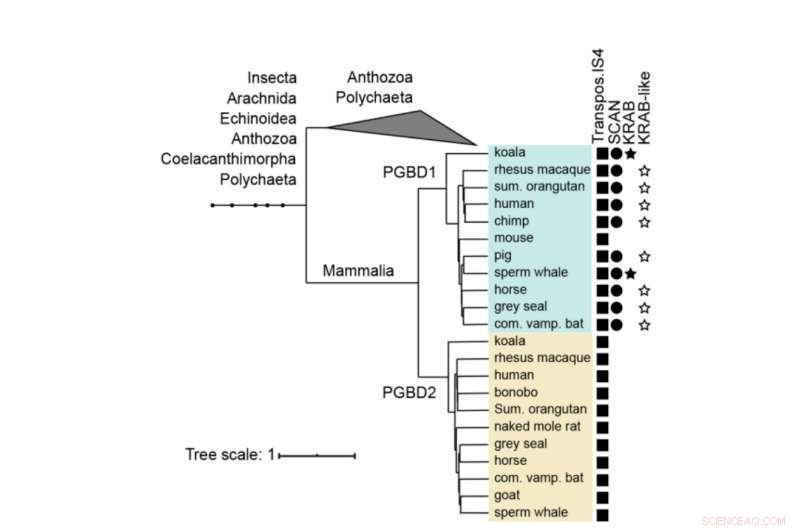
Fylogenetische boom van PGBD1 en PGBD2. De aanwezigheid van de van transposase afgeleide, de SCAN- en KRAB-domeinen worden getoond. De menselijke PGBD1 en PGBD2, met de meest nauw verwante sequenties (die transposase IS4) bevatten, werden uitgelijnd met spieren en er werd een boom gebouwd met behulp van MrBayes. Eiwitdomeinen werden geannoteerd met hmmerscan en CDD (NCBI). Het KRAB-domein is geannoteerd met Phyre2. Credit:Moleculaire biologie en evolutie (2022). DOI:10.1093/molbev/msac175
Evolutie wordt vaak afgeschilderd als een "knutsel"-proces, een proces dat gebruik maakt van kleine aanpassingen aan reeds bestaande mogelijkheden. Dus hoe evolueren organismen gloednieuwe structuren?
Een nieuwe studie door Dr. Zsuzsanna Izsvák van het Max Delbrück Centrum voor Moleculaire Geneeskunde in de Helmholtz Association (Max Delbrück Centrum) en Professor Laurence Hurst van het Milner Centrum voor Evolutie aan de Universiteit van Bath (VK) vonden bewijs dat de evolutie van een nieuw gen ondersteunt de evolutie van een nieuwe structuur in zenuwcellen. Ze beschrijven dit ongebruikelijke gen genaamd piggyBac Transposable Element-afgeleide 1, of PGBD1, in het tijdschrift Molecular Biology and Evolution .
'Springende genen' veroorzaken mutaties
PGBD1 is een van de vijf verwante PGBD-genen die een duidelijke gelijkenis vertoont met het piggyBac-element dat voor het eerst werd geïdentificeerd in insecten - vandaar de naam piggyBac Transposable Element-afgeleid. De PiggyBac-elementen zijn "springgenen", ook wel transposons genoemd. Ze zijn in staat zichzelf te kopiëren en van de ene locatie in het genoom naar de andere te gaan, waarbij ze soms mutaties introduceren of functies veranderen. PiggyBac-transposons zijn via horizontale overdracht in onze soort terechtgekomen - vergelijkbaar met hoe sommige virussen hun genoom in ons DNA kunnen integreren.
Hoewel de piggyBac-transposons in de loop van de tijd hun vermogen om rond te springen in ons DNA hebben verloren, zijn er vijf van piggyBac Transposable Element-afgeleide genen (PGBD1-5) bij mensen gefixeerd. "We wilden achterhalen welke potentieel nuttige functie de PGBD-genen zouden kunnen hebben", zegt Zsuzsanna Izsvák. "Voor dit onderzoek hebben we ons gericht op PGBD1."
Van de vijf PGBD-genen is PGBD1 uniek omdat het ook delen van andere genen heeft opgenomen, wat resulteert in een eiwit met extra delen die in staat zijn om andere eiwitten te binden en DNA te binden. PGBD1 is dus een nieuw gen dat deels een menselijk genfragment is, deels een inactief springgen.
PGBD1 reguleert zenuwcellen en hun 'eiwitvallen'
PGBD1 wordt alleen gevonden bij zoogdieren. Het is vooral actief in cellen die neuronen worden. De onderzoekers onderzochten eerst waar het PGBD1-eiwit zich bindt aan DNA, waarbij ze observeerden dat het zich vastplakt in en rond genen die verband houden met zenuwontwikkeling. Ze ontdekten dat PGBD1 de ontwikkeling van zenuwcellen regelt door genen te blokkeren die tot expressie worden gebracht in rijpe zenuwcellen, terwijl de genen die geassocieerd zijn met pre-zenuwcellen geactiveerd blijven. Door het niveau van PGBD1 in pre-zenuwcellen te verlagen, begonnen ze zich te ontwikkelen als zenuwcellen.
Een van de genen die het PGBD1-eiwit bindt, trok vooral hun interesse. NEAT1 is een vreemd gen dat codeert voor een RNA dat, ongebruikelijk, dan niet verder gaat met het maken van een eiwit. In plaats daarvan vormt dit product, een niet-coderend RNA, de ruggengraat van een fysieke structuur, de paraspeckles. Dit zijn kleine structuren in de kernen van sommige van onze cellen die fungeren als vallen voor sommige RNA's en eiwitten.
De onderzoekers ontdekten dat in pre-zenuwcellen het PGBD1-eiwit zich bindt aan het NEAT1-gen en ervoor zorgt dat het niet meer werkt. Wanneer de PGBD1-niveaus echter dalen, stijgen de NEAT1-RNA-niveaus, vormen zich paraspeckles en worden cellen volwassen zenuwcellen. PGBD1 is dus geëvolueerd tot een belangrijke regulator van de aan- of afwezigheid van paraspeckles, en dus de regulator van de ontwikkeling van zenuwcellen.
Evolutie is geen willekeurig knutselen
Wat echter het meest intrigerend is, is dat paraspeckles, net als PGBD1, ook zoogdierspecifiek zijn. PGBD1 is dan een zeldzaam voorbeeld van een nieuw gen dat is geëvolueerd om een nieuwe structuur te reguleren, zij het een vrij kleine. Zsuzsanna Izsvák, co-senior auteur van het Max Delbrück Center, zegt:"Dit is een echt ongebruikelijke en toevallige ontdekking. We weten dat duplicatie van reeds bestaande genen de evolutie van nieuwheid kan ondersteunen, maar dit is een zeldzaam voorbeeld van evolutie die meer dan alleen maar knutselen. Dit is een nieuw gen om een nieuwe structuur te controleren." De spannende vraag is nu of het ook een rol speelt in volwassen neuronen.
Mede-senior auteur professor Laurence Hurst van het Milner Center for Evolution aan de Universiteit van Bath voegt eraan toe dat ze "hebben uitgewerkt hoe paraspeckles worden gecontroleerd, nu moeten we alleen nog uitzoeken hoe de paraspeckle zelf is geëvolueerd. Dit kan een veel moeilijkere taak zijn omdat niet-coderende RNA's zoals NEAT1 de neiging hebben om snel te evolueren en daarom moeilijk te traceren zijn in de loop van de evolutie."
Deze koppeling tussen NEAT1 en PGBD1 kan ook betrokken zijn bij schizofrenie. Hoewel NEAT1 eerder in verband werd gebracht met deze neurologische ziekte, identificeerde het team enkele mutaties in PGBD1 waarvan ze konden aantonen dat ze ook vaak voorkomen bij patiënten met schizofrenie - een van deze mutaties verandert het eiwit van PGBD1, terwijl andere het niveau ervan kunnen regelen.
Eerste auteur Dr. Tamas Raskó, ten tijde van de studie een postdoctoraal onderzoeker in de groep van Zsuzsanna Izsvák, zegt dat "het zeker meer dan toeval is dat beide genen betrokken zijn bij schizofrenie. Het is zeer ongebruikelijk om een mutatie te vinden die een eiwit dat aan deze ziekte is gekoppeld. De effecten van deze mutatie moeten een prioriteit zijn voor verder onderzoek." + Verder verkennen
Wetenschappers ontrafelen het mysterie van genen die de sleutel zijn tot hersenontwikkeling
 Zeven dingen die aangeven dat een chemische verandering optreedt
Zeven dingen die aangeven dat een chemische verandering optreedt Wetenschappers ontwikkelen snelle chemie die een nieuwe klasse polymeren ontsluit
Wetenschappers ontwikkelen snelle chemie die een nieuwe klasse polymeren ontsluit Monitoring van de dynamiek van duizenden eiwitcomplexen tegelijk in intacte cellen
Monitoring van de dynamiek van duizenden eiwitcomplexen tegelijk in intacte cellen Serendipiteitsexperiment in de achtertuin werpt licht op de productie van polymeren
Serendipiteitsexperiment in de achtertuin werpt licht op de productie van polymeren Ontwikkeling van een rekbaar, door trillingen aangedreven apparaat met behulp van een vloeibaar elektreet
Ontwikkeling van een rekbaar, door trillingen aangedreven apparaat met behulp van een vloeibaar elektreet
 Dit koolstofarme plan heeft een economisch voordeel
Dit koolstofarme plan heeft een economisch voordeel Wildvuurrook kan regendruppels reduceren tot zinloze motregen, studie zegt. Hier is hoe
Wildvuurrook kan regendruppels reduceren tot zinloze motregen, studie zegt. Hier is hoe Chileense dennenbossen:een botanische dinosaurus met uitsterven bedreigd?
Chileense dennenbossen:een botanische dinosaurus met uitsterven bedreigd? Hoe te vertellen of een pauw mannelijk of vrouwelijk is
Hoe te vertellen of een pauw mannelijk of vrouwelijk is Mist er een cruciaal onderdeel van de zeespiegelstijging?
Mist er een cruciaal onderdeel van de zeespiegelstijging?
Hoofdlijnen
- Nieuwe sorghumcultivars kunnen duizenden liters ethanol produceren
- Stappen voor het traceren van een plant:zaadverspreiding volgen met behulp van chloroplast-DNA
- Iran verhuist om laatste mascotte Aziatische cheeta's te redden
- Onderzoek toont een manier om een gemeenschappelijke basis te creëren over gen-editing
- Planten die stikstof uit de lucht halen, gedijen goed in droge omgevingen
- Wetenschappers voltooien conserveringspuzzel, begrip van het leven op aarde vormen
- Artificiële intelligentie gebruiken om tuberculosebehandelingen te verbeteren
- Maak een lijst van de 3 stappen die optreden tijdens de interfase
- Verschillende soorten cellulaire communicatie
- Wedstrijden om vrouwelijke aandacht maken van mannen betere presteerders - in fruitvliegjes
- Gene drive-technologieën voor het behoud van ecosystemen:gebruik met zorg
- Haaien evolueerden vliegtuigachtige attributen om in habitats te passen

- Onderzoekers brengen druggable genomische doelwitten in kaart in evoluerende malariaparasieten
- Stop en ga in het kaliumkanaal

 Telescopen en satellieten worden gecombineerd om de grondbewegingen van hele planeten in kaart te brengen
Telescopen en satellieten worden gecombineerd om de grondbewegingen van hele planeten in kaart te brengen Gestrand op Mesozoïcum Madagaskar:onderzoekers ontdekken 66 miljoen jaar oud gek beest
Gestrand op Mesozoïcum Madagaskar:onderzoekers ontdekken 66 miljoen jaar oud gek beest Hoe het Scroll Grid te gebruiken in het Everyday Math-programma
Hoe het Scroll Grid te gebruiken in het Everyday Math-programma Zelfs de mooiste kaarten kunnen misleidend zijn
Zelfs de mooiste kaarten kunnen misleidend zijn Hij zag een kernbomtest op de Marshalleilanden van dichtbij. Het achtervolgt hem sinds 1952
Hij zag een kernbomtest op de Marshalleilanden van dichtbij. Het achtervolgt hem sinds 1952 Nieuwe geleiders met een hoog protonengehalte met inherent zuurstofarme lagen openen een duurzame toekomst
Nieuwe geleiders met een hoog protonengehalte met inherent zuurstofarme lagen openen een duurzame toekomst Random access memory op een energiezuinig dieet:onderzoekers ontwikkelen basis voor een nieuwe geheugenchip
Random access memory op een energiezuinig dieet:onderzoekers ontwikkelen basis voor een nieuwe geheugenchip NASA vindt windschering beïnvloed nieuwe tropische cycloon 09S
NASA vindt windschering beïnvloed nieuwe tropische cycloon 09S
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

