
Wetenschap
Moleculaire koekjesvormers gebruiken om de organisatie van membraaneiwitten te bekijken

Het membraan dat een biologische cel omhult, is niet simpelweg een barrière; het zit boordevol eiwitten die betrokken zijn bij allerlei kritische biologische functies. Om echt te begrijpen wat membraaneiwitten doen en hoe, moeten onderzoekers weten hoe ze zijn georganiseerd en hoe ze met elkaar omgaan. Maar het blootleggen van die informatie is een uitdaging.
Yale-onderzoekers hebben nu een nieuwe microscopiemethode ontwikkeld, Native-nanoBleach genaamd, die de belangrijkste uitdagingen voor het begrijpen van de organisatie van membraaneiwitten overwint, inclusief de moeilijkheid om deze membranen te bestuderen zonder de oorspronkelijke omgeving te verstoren en de beperkingen van de resolutie van lichtmicroscopen die doorgaans worden gebruikt om ze te bestuderen.
En om de effectiviteit van de nieuwe methode aan te tonen, pasten ze deze met succes toe op een biologisch raadsel – met betrekking tot eiwitten die betrokken zijn bij de ontwikkeling van alvleesklierkanker en hoe deze zouden kunnen worden behandeld – dat al tientallen jaren onopgelost is gebleven.
Ze beschrijven de nieuwe methode en de voordelen ervan in een nieuwe studie gepubliceerd in Nature Nanotechnology .
Methoden die doorgaans worden gebruikt bij de studie van de organisatie van membraaneiwitten vereisen het verwijderen van de oorspronkelijke membraanomgeving rond eiwitten en het vervolgens plaatsen van geïsoleerde interessante eiwitten in omgevingen die de complexiteit van het echte celmembraan nabootsen, maar niet volledig repliceren, zei Moitrayee Bhattacharyya, universitair docent farmacologie. aan de Yale School of Medicine en senior auteur van de studie. Deze aanpak, zegt Bhattacharyya, verwijdert belangrijke context omdat de eiwitten interageren met de moleculen die hen omringen.
Ten tweede hebben lichtmicroscopen, die gewoonlijk worden gebruikt om de organisatie van eiwitten te observeren, niet de resolutie die nodig is om te bepalen of eiwitten die zich dicht bij elkaar bevinden daadwerkelijk met elkaar in wisselwerking staan, of eenvoudigweg buren zijn op membranen.
Ten slotte kan de hoeveelheid van een bepaald eiwit in een celmembraan te laag of te hoog zijn voor de huidige onderzoeksmethoden. In die gevallen moeten onderzoekers aanpassingen maken; ze moeten ofwel eiwitten repliceren die in hun natuurlijke staat te weinig in aantal zijn, ofwel eiwitten scheiden uit monsters waar er te veel zijn. Maar dit kan opnieuw belangrijke context wegnemen over de natuurlijke staat van eiwitten zoals ze in celmembranen zitten en functioneren.
"In het ideale geval zouden we een methode hebben die zou werken met elk endogeen niveau van celmembraaneiwitexpressie", aldus Bhattacharyya.
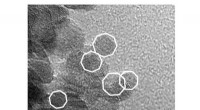
Om de eerste uitdaging aan te gaan, gebruikten de onderzoekers bepaalde moleculen, soorten polymeren, om eiwitcomplexen in wezen uit te schakelen terwijl het omringende celmembraan intact was. "Het is alsof het celmembraan een stuk koekjesdeeg is en de polymeren koekjesvormers", zegt Bhattacharyya.
Deze stukjes eiwit met omringend celmembraan, native nanodiscs genoemd, hebben een diameter van ongeveer 10 nanometer, klein genoeg dat alle eiwitten in de nanodisc waarschijnlijk een interactie aangaan, waarmee de tweede uitdaging wordt aangepakt. Bovendien werkt deze aanpak met elk celmembraaneiwit in elke hoeveelheid, waardoor onderzoekers eiwitten op hun natuurlijke niveaus in natuurlijke membranen kunnen observeren.
Zodra de nanoschijven zijn gegenereerd, kunnen onderzoekers een aantal veelgebruikte technieken gebruiken om een bepaald eiwit van interesse aan te scherpen. Vervolgens kwantificeren ze de eiwitten in elke nanoschijf met behulp van fluorescerende moleculen die eraan vastzitten.
Het is een aanpak die een hoge ruimtelijke resolutie biedt zonder de noodzaak van gespecialiseerde hardware, zegt Bhattacharyya.
"Dit werk presenteert een nieuwe techniek om te begrijpen hoe membraaneiwitten – die ongeveer 60% van de medicijndoelen vertegenwoordigen – zich assembleren tot functionele eenheden op of binnen de natuurlijke lipidedubbellaag", zegt Gerard Walker, co-eerste auteur van het artikel en een afgestudeerde student. in het laboratorium van Bhattacharyya.
Om aan te tonen hoe deze methode kan worden toegepast, zijn de onderzoekers een decennia lang debat in de biologie aangegaan. Een eiwit genaamd KRas is gemuteerd in meer dan 90% van de menselijke pancreaskankers, wat een enorme klinische en therapeutische belangstelling wekt. Of KRas-subeenheden samenkomen om dimeren (twee eenheden) of oligomeren (meer dan twee eenheden) op celmembranen te vormen, is de focus gebleven van langdurig onderzoek.
Studies hebben echter tegenstrijdige bevindingen opgeleverd. Dier- en cellulaire studies, waarbij gedetailleerde moleculaire resolutie ontbreekt, tonen bewijs dat KRas-eenheden samenkomen op celmembranen. Ondertussen hebben biofysische analyses, waarbij het oorspronkelijke membraan rond eiwitten niet behouden blijft, KRas-resten in afzonderlijke eenheden of monomeren ontdekt.
"Met onze methode halen we het beste van twee werelden", aldus Bhattacharyya. "We behouden de natuurlijke membraanomgeving en we hebben een zeer hoge ruimtelijke resolutie en resolutie van één molecuul. Toen we onze methode toepasten, ontdekten we dat KRas in vergelijkbare hoeveelheden als dimeren en monomeren bestaat. Maar wanneer KRas wordt gemuteerd, zoals bij pancreaskanker, dimeren toenemen en monomeren afnemen."
De bevinding benadrukt het belang van het natieve celmembraan voor het begrijpen van membraaneiwitten en identificeert een doelwit – het verminderen van KRas-dimerisatie – voor de behandeling van kanker. Dit is slechts een van de vele manieren waarop deze methode kan worden gebruikt om de rol van membraaneiwitorganisatie bij ziekten te begrijpen, aldus Bhattacharyya.
"Het is echt de moeite waard om te zien dat Native-nanoBleach al met succes wordt toegepast op een breed scala aan prangende biologische vragen in het Bhattacharyya-lab en daarbuiten", zegt Caroline Brown, co-eerste auteur van de studie en een Ph.D. kandidaat in het lab van co-auteur Kallol Gupta, universitair docent celbiologie.
Membraaneiwitten vormen een derde van alle eiwitten in het menselijk lichaam en deze aanpak kan worden gebruikt om al deze eiwitten te bestuderen, aldus Bhattacharyya.
"Het is een algemene techniek", zei ze. "Er is eigenlijk geen beperking."
In de toekomst hopen Bhattacharyya en haar collega's deze aanpak uit te breiden naar het bestuderen van de eiwitorganisatie in de membranen van verschillende organellen, structuren, zoals mitochondriën, die zich in cellen bevinden.
Meer informatie: Gerard Walker et al, Oligomere organisatie van membraaneiwitten van natieve membranen met ruimtelijke resolutie en resolutie van één molecuul op nanoschaal, Natuurnanotechnologie (2023). DOI:10.1038/s41565-023-01547-4
Journaalinformatie: Natuurnanotechnologie
Aangeboden door Yale Universiteit
 Klimaatgedreven evolutie in bomen verandert hun ecosystemen
Klimaatgedreven evolutie in bomen verandert hun ecosystemen Waar vind ik meelwormen?
Waar vind ik meelwormen?  Wetenschappers onthullen hoe de fossiele brandstofindustrie het publiek misleidde over klimaatverandering
Wetenschappers onthullen hoe de fossiele brandstofindustrie het publiek misleidde over klimaatverandering Invasieve en inheemse moerasgrassen kunnen vergelijkbare voordelen bieden als beschermde wetlands
Invasieve en inheemse moerasgrassen kunnen vergelijkbare voordelen bieden als beschermde wetlands Mysterie opgelost:zuurgraad van de oceaan bij de laatste massale uitsterving
Mysterie opgelost:zuurgraad van de oceaan bij de laatste massale uitsterving
Hoofdlijnen
- Wat zijn Twisted DNA-strengen in de kern van het cellichaam?
Desoxyribonucleïnezuur, of DNA, is het materiaal dat door de natuur wordt geselecteerd om de genetische code van de ene generatie van een soort naar de volgende over te brengen. Elke soor
- Wat is de elektrische impuls die een Axon naar beneden beweegt?
- Over leverfuncties in het menselijk lichaam
- Fokresistente kippen voor verbeterde voedselveiligheid
- Studie koppelt koudwaterschok aan catastrofale instorting van koraal in de oostelijke Stille Oceaan
- Geavanceerde beeldvorming werpt licht op immuunontsnapping van vormveranderende schimmel
- Kunstmatig leven
- Hoe moleculaire scharen ziekten kunnen oplossen en DNA kunnen bewerken
- Sumatraanse neushoorns zijn nooit hersteld van verliezen tijdens het Pleistoceen, genoom bewijs toont
- Nieuwe nanostructuren kunnen smartphones efficiënter maken

- Nieuwe magnetisch gecontroleerde trombolyse heeft preklinische tests met succes doorstaan
- Kleinst mogelijke diamanten vormen ultradunne nanothreads

- Optofluidic-chip met slimme poort met nanoporiën, ontwikkeld voor analyse van één molecuul
- Strain maakt nieuwe toepassingen van 2D-materialen mogelijk

 Wat zijn Rainforest Decomposers?
Wat zijn Rainforest Decomposers?  Celestial Sleuth identificeert de stellaire inspiratie van Lord Byron
Celestial Sleuth identificeert de stellaire inspiratie van Lord Byron NASA ziet verticale windschering van invloed op tropische storm Muifa
NASA ziet verticale windschering van invloed op tropische storm Muifa Vooruitgang in op nanoschaal gebaseerde benaderingen om de werkzaamheid van podofyllotoxine te verbeteren
Vooruitgang in op nanoschaal gebaseerde benaderingen om de werkzaamheid van podofyllotoxine te verbeteren  Hoe mensen mijn robijnen?
Hoe mensen mijn robijnen?  De vooruitgang in de nanogeneeskunde toont potentieel voor gepersonaliseerde point-of-care-therapieën
De vooruitgang in de nanogeneeskunde toont potentieel voor gepersonaliseerde point-of-care-therapieën  Amerikaanse sonde landt op 20 oktober op asteroïde Bennu
Amerikaanse sonde landt op 20 oktober op asteroïde Bennu Zelfs opvoeders geloven veelvoorkomende mythes over leren,
Zelfs opvoeders geloven veelvoorkomende mythes over leren,
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

