Wetenschap
Ontdekking van de moleculaire herkenning van technologische vaste stoffen door mutante zelfassemblerende peptiden
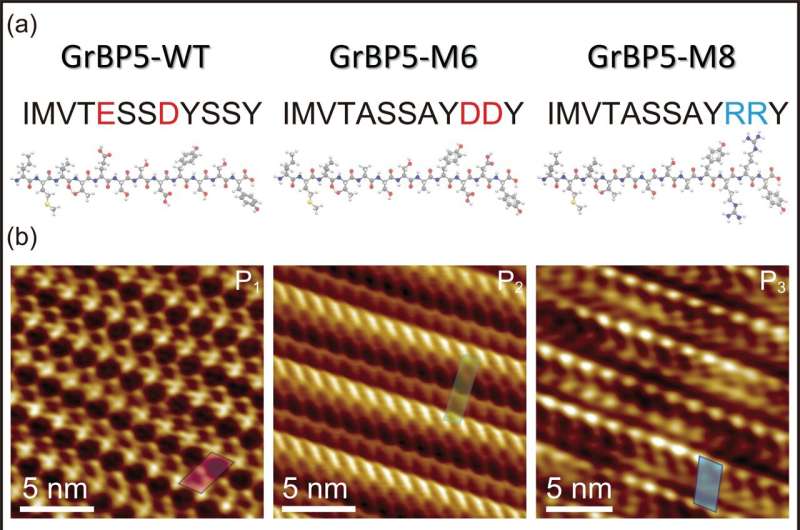
Dat blijkt uit een onderzoek dat onlangs is gepubliceerd in het tijdschrift Small gebruikten onderzoekers van het Nano Life Science Institute (WPI NanoLSI), Kanazawa University, Japan, in samenwerking met professor Sarikaya, Seattle, VS, frequentiegemoduleerde atoomkrachtmicroscopie om de moleculaire architectuur van genetisch ontworpen en puntgemuteerde peptiden en hun zelforganisaties te onthullen. vorming van dikke, afzonderlijke biologische kristallen van één molecuul op atomair vlak grafiet en MoS2 oppervlakken, wat een potentieel platform biedt voor hybride technologieën zoals bio-elektronica, biosensoren en eiwitarrays.
Eiwitten zijn de belangrijkste moleculaire bouwstenen in de biologie, voeren enzymatische functies uit, transporteren ionen en elektronen en vormen de belangrijkste infrastructuur van cellulaire architecturen, zoals ionenpompen. De functies van eiwitten zijn afhankelijk van hun aminozuursequenties, die op hun beurt hun driedimensionale moleculaire structuren dicteren.
De aminozuursequenties van eiwitten worden gecodeerd door de genen (DNA-code) van een bepaalde gespecialiseerde cel. Elk defect in de aminozuursequentie, zoals een puntmutatie, een verandering in de locatie van een aminozuur, een ontbrekend aminozuur of de transpositie van twee of meer aminozuren, zal daarom naar verwachting de moleculaire structuur van het eiwit beïnvloeden. , wat tot uiting komt in hun functie, wat vaak leidt tot genetische ziekten.
Net als eiwitten zijn peptiden ook samengesteld uit aminozuureenheden, en elk peptide heeft een unieke sequentie; ze zijn echter veel korter, variërend van 10 tot 30 eenheden, en worden op dezelfde manier gecodeerd door DNA. Ze zijn gemakkelijker te manipuleren, ontwerpen en gebruiken in vergelijking met eiwitten, die veel groter zijn (honderden of duizenden aminozuren lang), moeilijk te synthetiseren en onpraktisch in gebruik.
Daarom is het absoluut noodzakelijk dat als de praktische technologie van de toekomst ontwikkeld moet worden op basis van lessen uit de biologie op moleculaire schaal, de fundamentele wetenschap moet worden gevestigd met behulp van peptiden, die vervolgens kunnen worden geïmplementeerd in toepassingen in de echte wereld, zoals biosensoren. , bio-elektronica en logische apparaten, maar ook medicijnen, allemaal gebaseerd op lessen uit de biologie.
Professor Sarikaya realiseerde zich dit uitgangspunt en initieerde twintig jaar geleden een nieuwe benadering van de convergentiewetenschap, waarbij genetische manipulatie, moleculaire biologie, informatica, machinaal leren en materiaalkunde en -techniek betrokken waren bij het ontwerpen van solide bindende peptiden, en demonstreerde hun gebruik in praktische hybride technologieën. /P>
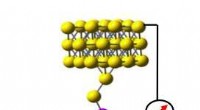
In deze nieuwe studie wordt een van deze peptiden, specifiek ontworpen als een grafietbindend peptide, gemuteerd in twee verschillende peptiden, M6 en M8, die elk nominaal hetzelfde molecuulgewicht en dezelfde grootte hebben, maar puntmutaties van de geladen aminozuren bevatten. en de andere positieve, respectievelijk.
Zoals voorspeld zouden ze anders functioneren, wat ze ook deden. De vraag die onmogelijk a priori te voorspellen was, was echter hoe ze zich precies anders zouden gedragen dan elkaar en het wildtype (het oorspronkelijke) peptide, en wat de details zouden zijn van hun moleculaire structuur en hun kinetisch gedrag op het oppervlak van de peptiden. substraat grafiet.
De antwoorden op deze vragen, waarvan het gebrek tot nu toe het begrip van de relatie tussen mutanten en hun voorspelbare gedrag beperkte, vereisten een zeer hoge resolutie en directe beeldvorming van de moleculen in hun oorspronkelijke staat, in water gedurende een periode van seconden tot uren. /P>
Dit is waar het laboratorium van professor Takeshi Fukuma in beeld komt bij het WPI Nano Life Science Institute, Kanazawa University, waar zijn team Frequency-Modulated Atomic Force Microscopie-faciliteiten heeft ontwikkeld die in staat zijn objecten op moleculaire schaal te ondervragen met een beeldresolutie van bijna Angström en voor lange perioden in waterige omgevingen – een ongebruikelijke combinatie van mogelijkheden voor een experimenteel systeem, vooral voor biologisch onderzoek.
Met de zeer bekwame experimentele vaardigheden van de onderzoekers (met onuitputtelijk geduld bij langdurige tests), onder leiding van dr. Ayhan Yurtsever, dr. Kaito Hirata, dr. Linhao Sun en dr. Takeshi Fukuma, ontdekte het team het gedrag van de mutanten in ongekend detail, wat resultaten oplevert met een betekenis die verschillende traditioneel diverse disciplines doorkruist, van materiaalkunde tot natuurkunde, tot scheikunde en biologie.
Ten eerste bond elk peptide, ondanks de mutaties en individueel een verschillende totale lading, niet alleen aan het grafietoppervlak, maar assembleerde het ook, waardoor peptidekristallen van één molecuul dik werden gevormd. Terwijl de eerste mutant, de negatief geladen, een kristallijn schuin rooster vormde met twee moleculen (om elkaar heen gewikkeld) in elk rooster, vormde de tweede mutant, de positief geladen, een ander schuin rooster dat een enkel peptide bevatte. /P>
Wat hier echt waardevol is, is dat het gedrag van de peptiden eenvoudig en direct verband houdt met hun moleculaire architectuur, gemodelleerd met behulp van moleculaire dynamica. De onderzoekers waren daardoor in staat om op wiskundige wijze de relatie te beschrijven tussen elk van de peptiden (die elk een ander schuin moleculair rooster vormen) en het hexagonale rooster van het grafietsubstraat, dat uitsluitend wordt beschreven als chirale herkenning.
In feite betekent dit dat van elk peptide is aangetoond dat het een hybride grensvlak vormt met het substraatgrafiet, het best te omschrijven als kristallografisch coherent zonder merkbare kloof ertussen, vergelijkbaar met ligand-receptor- of eiwit/DNA-interacties in de biologie.
Noch de moleculaire herkenning van vaste-stofobjecten door een ‘levend’ molecuul is eerder zo duidelijk waargenomen, noch zijn de details ervan als chiraal beschreven, wat beide bijdraagt aan de betekenis van de resultaten die in deze publicatie worden gepresenteerd.
Aan de ene kant zijn er vanuit biologisch perspectief nu voldoende gegevens en details over hoe mutaties leiden tot moleculaire conformationele veranderingen en de daaruit voortvloeiende functie van de peptiden, die kan worden uitgebreid naar het gedrag van eiwitten, met betekenis in genetische mutaties en effectieve medicijnontwerp.
En aan de andere kant suggereert coherente hybridisatie dat levende en levenloze objecten op nanoschaal stabiel aanwezig zijn op hetzelfde zachte grensvlak, en een exclusieve moleculaire brug vormen die het beste kan worden beschreven door biologie naadloos te integreren met halfgeleiderapparaten.
Als dat zo is, wordt op basis van deze studie verwacht dat wetenschappers en technologen het repertoire van de moleculaire basis van toekomstige bio/nano-apparaten enorm zullen verbreden door gebruik te maken van het eenvoudige moleculair biologische instrument van mutatie.
Meer informatie: Ayhan Yurtsever et al., Dynamiek van moleculaire zelfassemblage van korte peptiden op vloeistof-vaste grensvlakken – effect van geladen aminozuurpuntmutaties, Klein (2024). DOI:10.1002/klein.202400653
Journaalinformatie: Klein
Aangeboden door Kanazawa Universiteit
 Een innovatief proces voorkomt onomkeerbaar energieverlies in batterijen
Een innovatief proces voorkomt onomkeerbaar energieverlies in batterijen Voorbeelden van verdamping en destillatie
Voorbeelden van verdamping en destillatie Ontdekking kan nucleair afval verminderen met een verbeterde methode om moleculen chemisch te ontwikkelen
Ontdekking kan nucleair afval verminderen met een verbeterde methode om moleculen chemisch te ontwikkelen Zoutoplossing produceert betere organische elektrochemische transistors
Zoutoplossing produceert betere organische elektrochemische transistors Begrijpen wat Tennessee whisky uniek maakt
Begrijpen wat Tennessee whisky uniek maakt
 Westelijke wind op zuidelijk halfrond zal waarschijnlijk toenemen naarmate het klimaat warmer wordt
Westelijke wind op zuidelijk halfrond zal waarschijnlijk toenemen naarmate het klimaat warmer wordt Onderzoekers ontdekken dat het duurzaamheidsprogramma van grote voedselretailers de milieupraktijken van boeren stimuleert
Onderzoekers ontdekken dat het duurzaamheidsprogramma van grote voedselretailers de milieupraktijken van boeren stimuleert 'S Werelds grootste meren onthullen trends in klimaatverandering
'S Werelds grootste meren onthullen trends in klimaatverandering NASA-camera op afstand levert nieuwe aardebeelden op
NASA-camera op afstand levert nieuwe aardebeelden op Regeneratieve landbouw kan boeren weer rentmeesters van het land maken
Regeneratieve landbouw kan boeren weer rentmeesters van het land maken
Hoofdlijnen
- Zou het hebben van een eigen kloon hetzelfde zijn als het hebben van een identieke tweeling?
- Freud en Oedipus:doet een van beide er nog toe?
- Goud zeven uit de datastroom
- Hoe bavianen gezonde gezinsgrenzen bewaren
- Wetenschappers ontdekken dat schorpioenen zich richten op hun gif
- We volgen de voetstappen van het Noord-Chinese luipaard
- Team rapporteert over een schimmel die tegelijkertijd twee van de ergste bedreigingen voor bananenplantageopbrengsten bestrijdt
- Duizenden pinguïnkuikens verhongeren op Antarctica
- Uit onderzoek blijkt hoe een suikergevoelig eiwit fungeert als een machine om de plantengroei (en de olieproductie) aan en uit te zetten
 Honingraat van nanobuisjes kan genetische manipulatie stimuleren
Honingraat van nanobuisjes kan genetische manipulatie stimuleren Nieuw virus geïdentificeerd in zebravissen uit de dierenhandel veroorzaakt ziekte bij laboratoriumvissen
Nieuw virus geïdentificeerd in zebravissen uit de dierenhandel veroorzaakt ziekte bij laboratoriumvissen  Les uit de voorspelling van Arctisch zee-ijs in 2020:voorspelling van sub-seizoen tot seizoen blijft een uitdaging
Les uit de voorspelling van Arctisch zee-ijs in 2020:voorspelling van sub-seizoen tot seizoen blijft een uitdaging Nieuwe nanosensoren maken diagnostische procedures gevoeliger
Nieuwe nanosensoren maken diagnostische procedures gevoeliger  Nieuw algoritme voor het simuleren van de structuur van kwantumsystemen op een kwantumfotonische chip
Nieuw algoritme voor het simuleren van de structuur van kwantumsystemen op een kwantumfotonische chip Het werk van wetenschappers kan een antwoord bieden op het mysterie van Mars
Het werk van wetenschappers kan een antwoord bieden op het mysterie van Mars Grote witte haai genaamd George stalkt Everglade wateren
Grote witte haai genaamd George stalkt Everglade wateren Ingenieurs testen LiDAR-systeem bedoeld voor ruimtemissies
Ingenieurs testen LiDAR-systeem bedoeld voor ruimtemissies
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com