
Wetenschap
DNA gehecht aan nanodeeltjes blijkt bij te dragen aan de symptomen van lupus
Auto-immuunziekten zijn mysterieus. Pas in de jaren vijftig realiseerden wetenschappers zich dat het immuunsysteem de organen van het eigen lichaam kon beschadigen. Zelfs vandaag de dag blijven de fundamentele oorzaken en innerlijke werking van de meeste auto-immuunziekten slecht begrepen, waardoor de behandelingsmogelijkheden voor veel van deze aandoeningen beperkt worden.
De afgelopen jaren heeft onderzoek echter aanwijzingen gevonden voor de manier waarop auto-immuunziekten kunnen ontstaan. Dit onderzoek heeft aangetoond dat DNA dat vastzit aan kleine deeltjes in de bloedbaan een waarschijnlijke boosdoener is die betrokken is bij veel auto-immuunziekten, vooral systemische lupus erythematosus, of kortweg lupus, die vooral jonge vrouwen treft en nierbeschadiging kan veroorzaken.
Vanwege de grote verscheidenheid in grootte van zowel deeltjes als DNA in het bloed is het testen in welke mate en onder welke omstandigheden deze combinaties van DNA-deeltjes een rol spelen bij ziekten echter uiterst moeilijk.
Onderzoekers van Duke University hebben nu een manier ontwikkeld om systematisch te testen hoe deze DNA-gebonden deeltjes interageren met het immuunsysteem. Door kleine deeltjes van specifieke grootte te gebruiken, DNA-strengen van bepaalde lengtes te bevestigen en de resulterende complexen bloot te stellen aan immuuncellen in een laboratoriumschaal, laten de onderzoekers zien dat een beter fundamenteel begrip van deze ziekten mogelijk is.
De resultaten zijn gepubliceerd in de Proceedings of the National Academy of Sciences .
"Onze aanpak identificeerde de cellulaire route die de schadelijke reactie op deze hybride deeltjes veroorzaakt, en toonde aan dat DNA dat aan de oppervlakken van nanodeeltjes is gebonden, wordt beschermd tegen afbraak door enzymen", zegt Christine Payne, hoogleraar Werktuigbouwkunde en Materiaalwetenschappen van de Yoh Family. . "Wij denken dat dit uiterst belangrijke resultaten zijn die de basis zullen vormen voor toekomstige studies met ons nieuwe systeem."
Hoewel DNA meestal opgesloten zit in de celkern, komt het vaak in de bloedbaan terecht als cellen afsterven of worden aangevallen door virussen en bacteriën. Hoewel het meeste zogenaamde ‘celvrije DNA’ slechts enkele minuten meegaat voordat het door het lichaam wordt afgebroken, kan het bij sommige mensen en situaties veel langer aanhouden. Uit recent onderzoek blijkt dat hoge niveaus van celvrij DNA nauw verband houden met de ernst van lupussymptomen, en veel artsen testen nu manieren om het te gebruiken om de ziekteactiviteit te monitoren.
Celvrij DNA kan grotendeels aan eliminatie ontsnappen door complexen te vormen met andere moleculen of zichzelf te hechten aan natuurlijk voorkomende deeltjes. Afhankelijk van de oorsprong van het DNA kan de lengte variëren van enkele honderden basenparen tot enkele duizenden. En de deeltjes waaraan het zich kan hechten, variëren van 100 tot 1000 nanometer in diameter.
"Experimenteren met de deeltjes die daadwerkelijk in bloed worden aangetroffen, is moeilijk omdat ze in zoveel verschillende maten en combinaties voorkomen", zegt dr. David Pisetsky, hoogleraar geneeskunde en integratieve immunobiologie aan de Duke University School of Medicine.
"Waar eerder werk zich richtte op het gebruik van nanodeeltjes voor therapie, onderzoeken we hier het gebruik van deelwoorden om ziektemechanismen te begrijpen, wat zeer informatief kan zijn voor belangrijke medische vragen." Payne werkte samen met leden van haar laboratorium om streng gecontroleerde synthetische deeltjes te fabriceren aan beide uiteinden van het natuurlijk voorkomende groottespectrum.
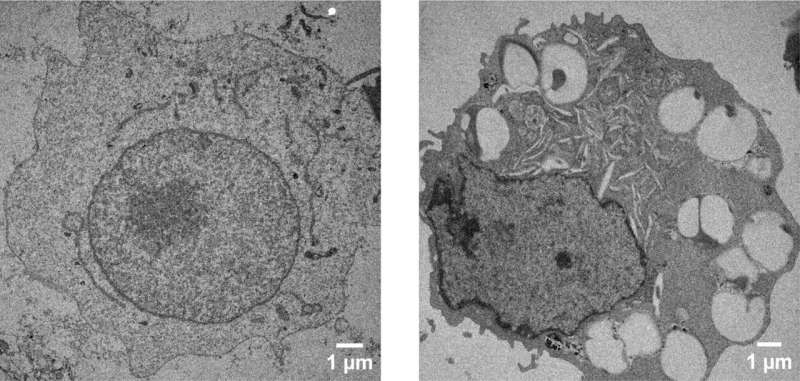
Vervolgens bevestigden ze DNA-strengen van E. Coli, een paar honderd basenparen lang of 10.000 basenparen lang, aan zowel grote als kleine deeltjes. Met een breed scala aan synthetische DNA-deeltjescomplexen in de hand mengden ze verschillende combinaties met menselijke macrofagen, een soort witte bloedcel die micro-organismen omringt en doodt, dode cellen verwijdert en de werking van andere immuuncellen stimuleert.
"Ik ben ruim een jaar geleden bij het laboratorium gekomen en heb gewerkt aan het karakteriseren van de corona's van nanodeeltjes om hun grootte, hoeveelheid DNA en hoe het DNA afbreekt te begrijpen", zegt Diego Montoya, een derdejaarsstudent die in het laboratorium van Payne werkt en een co-auteur op papier. "Het was erg leuk en een voorrecht om met iedereen aan dit onderzoek te werken."
De eerste belangrijke observatie die het team deed was dat DNA dat aan nanodeeltjes was gehecht, beschermd was tegen afbrekende enzymen en dat grotere nanodeeltjes meer bescherming boden.
"We denken dat de enzymen mogelijk geen toegang kunnen krijgen tot het DNA om het te vernietigen vanwege de vorm die het DNA maakt met het oppervlak van het nanodeeltje", zegt Faisal Anees, een Ph.D. student in het laboratorium van Payne. "Maar er kunnen ook andere effecten optreden, dus dat is een vraag die we nu definitiefer proberen te beantwoorden."
De resultaten toonden aan dat de macrofagen op alle soorten DNA-deeltjescomplexen reageerden door ontstekingssignalen te produceren die andere cellen konden volgen, een kenmerk van veel auto-immuunziekten. Ze hebben ook aangetoond dat deze reactie wordt gecreëerd via een specifieke signaalroute genaamd cGAS-STING.
De onderzoekers benadrukken dat de gecombineerde resultaten nog geen bewijs bieden voor de oorzaak van lupus of andere auto-immuunziekten, die waarschijnlijk gevarieerd en genuanceerd zijn.
"Alle manieren waarop het immuunsysteem zichzelf aanvalt, zijn erg complex, moeilijk te begrijpen en moeilijk te behandelen," zei Payne. "Deze aanpak geeft onderzoekers een manier om factoren te analyseren en te lokaliseren die ze met een puur biologisch systeem niet zouden kunnen doen."
"We hebben nu een goed gedefinieerd modelsysteem dat ons de mogelijkheid geeft om deze vragen te stellen over causaliteit versus correlatie", voegde Pisetsky toe, die al bijna een halve eeuw onderzoek doet naar auto-immuunziekten. "Het geeft ons ook een nieuwe methode om potentiële therapieën te onderzoeken."