
Wetenschap
Het visualiseren van intracellulaire nanostructuren van levende cellen met behulp van nanoendoscopie-AFM

3D nano-endoscopie-AFM techniek. (A) Schematische voorstelling van de 3D-nanoendoscopie-AFM-methode, waarbij de nanosonde herhaaldelijk in de cel op verschillende posities in het gewenste gebied wordt geïntroduceerd. (B) FIB-gefabriceerde nanosonde die wordt gebruikt in de 3D-nanoendoscopie-AFM-metingen. (C en D) Typische F-z-curven verkregen door het binnendringen van een cel, waarbij een abrupte afname van de cantilever-afbuiging wordt weergegeven als een piek wanneer de nanosonde het externe celmembraan (C) binnendringt, en verschijnt als een andere piek in het geval dat de nanosonde het kernmembraan doorboort (D). (G) 3D-nanoendoscopie-AFM-celkaart van het gehele HeLa-celvolume (40 × 40 × 6 m3) ingesloten in het rode vierkant in (E), waar het celmembraan, de kern en cytoplasmatische gebieden kunnen worden onderscheiden in de dwarsdoorsnede weergegeven in (H). (I) 3D nano-endoscopie-AFM-afbeelding van een HeLa-celvolume (10 × 10 × 6 m3) ingesloten in het rode vierkant in (F), waar interne korrelige structuren duidelijk kunnen worden herkend. Krediet:Wetenschappelijke vooruitgang , 10.1126/sciadv.abj4990
Atoomkrachtmicroscopie (AFM) biedt een methode voor labelvrije beeldvorming van biomoleculaire dynamiek op nanoschaal om biologische vragen op te lossen die niet kunnen worden aangepakt via andere bioimaging-methoden, waaronder fluorescentie- en scanning-elektronenmicroscopie. Aangezien dergelijke beeldvormingsmethoden alleen mogelijk zijn voor biologische systemen die zijn geëxtraheerd uit cellen of zijn gereconstrueerd op vaste substraten, blijft nanodynamica in levende cellen grotendeels ontoegankelijk met bestaande biobeeldvormingsmethoden. In een nieuw rapport dat nu is gepubliceerd in Science Advances , hebben Marcos Penedo en een onderzoeksteam in Nanolife Science en biotechnologie aan de Kanazawa University in Japan de grenzen van bioimaging overwonnen door nano-endoscopie-AFM te gebruiken. Tijdens het proces brachten ze een naaldachtige sonde in een levende cel om actinevezel, driedimensionale (3D) kaarten en 2D-nanodynamica van de binnenste steiger van het membraan te presenteren met niet-detecteerbare veranderingen in de levensvatbaarheid van de cellen. In tegenstelling tot eerdere AFM-methoden, had de nanosonde rechtstreeks toegang tot de intracellulaire componenten van het doelwit en verkende hij de mogelijkheden van AFM, waaronder beeldvorming met hoge resolutie, nanomechanische mapping en moleculaire herkenning om het waarneembare bereik van intracellulaire structuren in levende cellen uit te breiden.
Biobeeldvorming van intracellulaire dynamiek
Dynamiek op moleculaire schaal van intracellulaire componenten geeft inzicht in de fundamentele mechanismen van celfuncties en ziekte. Directe beeldvormingsmethoden voor dergelijke nanodynamica in levende cellen zijn echter een uitdaging. Hoewel elektronenmicroscopie bijvoorbeeld nuttig is om nanostructuren van bevroren cellen in vacuüm af te beelden, zijn ze niet in staat om nanodynamica in levende cellen onder fysiologische omgevingen af te beelden, behalve als statische snapshots van vaste conformaties. Evenzo, terwijl fluorescentiemicroscopie via fluorescentie-etikettering een krachtige methode biedt om de dynamiek van eiwitten en organellen in levende cellen te visualiseren, worden ze beperkt door een onvermogen om efficiënt op nanoschaal af te beelden. Er bestaan daarom sterke eisen aan een labelvrije intracellulaire beeldvormingsmethode in vloeibare omgevingen. Atoomkrachtmicroscopie (AFM) is een potentiële kandidaat voor de rol met het vermogen om op sub-nanometerschaal afbeeldingen te maken om de nanodynamica van lipiden, eiwitten en DNA's zonder labels te visualiseren. Dergelijke beelden zijn echter niet representatief voor biologische systemen als gevolg van extractie uit een cel of reconstructie op een vast substraat in vitro. In dit werk, daarom, Penedo et al. stelde een op AFM gebaseerde beeldvormingsmethode voor die bekend staat als nano-endoscopie-AFM om nanodynamica in levende cellen te observeren zonder ze te labelen of uit elkaar te halen.
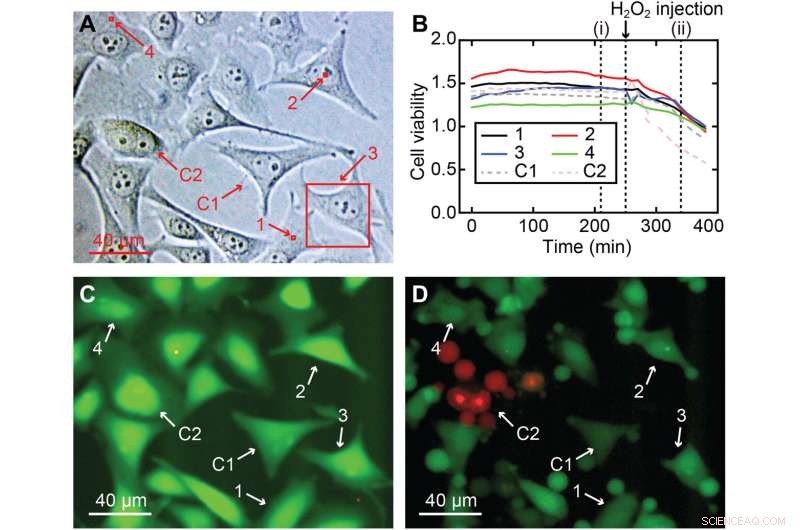
Levensvatbaarheid van de cellen van 3D nano-endoscopie-AFM-metingen. (A) Verschillende gemeten gebieden uitgevoerd in een HeLa-celcultuur voor de cellevensvatbaarheidstest, inclusief kern- en celperiferiegebieden:(1) 2 × 2 × 7 m3, (2) 2 × 2 × 10 μm3, (3) 40 × 40 × 8 m3, en (4) 2 × 2 × 7 m3, gemarkeerd in rode vierkanten; twee cellen werden als controle gebruikt, C1 en C2. (B) Cellevensvatbaarheidsverhoudingen in de loop van de tijd voor de vier afgebeelde cellen (1 tot 4) en voor de twee cellen die als controle werden gebruikt (C1 en C2), waaruit blijkt dat alle cellen (afgebeeld en controle) een vergelijkbare intensiteit van de levensvatbaarheid van de cellen hadden verhouding en bevestigen dat de cellen niet erg beschadigd waren. (C) voorbeeld van een fluorescentie-afbeelding na 210 min die overeenkomt met (i) in (B), waarbij de sterke groene kleur een normale esterase-activiteit betekent die wordt verwacht voor een levende cel. Om de validiteit van de test te controleren, werd H2O2 na 260 minuten aan het medium toegevoegd om de cellen te doden, wat resulteerde in een afname van de cellevensvatbaarheidsverhoudingen van alle cellen, een duidelijke indicatie dat cellen aan het sterven waren. (D) Fluorescentie momentopname die overeenkomt met de tijd (ii) in (B), waar tekenen van schade duidelijk zichtbaar zijn in alle cellen, waarvan de meeste al aan krimp of apoptose leden. Krediet:Wetenschappelijke vooruitgang , 10.1126/sciadv.abj4990
Nano-endoscopie-AFM-experimenten
Tijdens de experimenten plaatsten de onderzoekers, net als een endoscopische camera, een lange naaldachtige nanosonde in een levende cel om 2D- en 3D AFM-beeldvorming uit te voeren. Het team liet zien hoe nano-endoscopie-AFM een uniek voordeel bood voor labelvrije intracellulaire live-celbeeldvorming op nanoschaal. De methode biedt een krachtig pad om tot nu toe onontgonnen fenomenen in biologische systemen te observeren. Penedo et al. bracht herhaaldelijk de nanosonde in de cel op verschillende posities van het gewenste gebied via kracht- versus afstandscurvemetingen. Om de hele cel in beeld te brengen, moest de nanosonde lang genoeg zijn om de cel volledig te penetreren totdat deze het substraat bereikte, en met een diameter van minder dan 200 nm om celbeschadiging te minimaliseren, terwijl membraanpenetratie werd vergemakkelijkt. Het team gebruikte een commerciële tetraëdrische punt van silicium als nanosonde, die ze met behulp van gefocusseerde ionenbundelfrezen tot de gewenste afmetingen hebben gefreesd. Het team gebruikte vervolgens de nanosondes in verschillende delen van een HeLa-cel. Ze verwierven tijdens de experimenten een 3D nano-endoscopie-AFM-beeld van een hele cel en identificeerden de kern van de HeLa-cel van de rest van de cel. Verdere metingen gaven ook de interne granulaire structuren aan. Om celbeschadiging tijdens penetratie te minimaliseren, Penedo et al. de penetratiekracht en de inkepingslengte zoveel mogelijk verminderd. Ze voerden ook cellevensvatbaarheidsexperimenten uit om te bevestigen dat 3D nano-endoscopie-AFM niet leidde tot ernstige celbeschadiging bij gebruik van nanosondes met een diameter van minder dan 200 nm. Met behulp van 3D nano-endoscopie-AFM faciliteerden ze de beeldvorming van het interne cytoskelet in levende cellen om de 3D-organisatie van de niet-ondersteunde vezels te observeren. Het team heeft ook met succes intracellulaire beelden samengevoegd die het resultaat zijn van 3D nano-endoscopie-AFM en confocale microscopie.

Combinatie van confocale beeldvorming en 3D nano-endoscopie-AFM. (A) Confocale fluorescentie afbeelding waar de gekleurde actine filamenten zichtbaar zijn. (B) de vergrote afbeelding verkregen op het gebied dat wordt aangegeven door het rode vierkant in (A). (C en D) 3D-nanoendoscopie-AFM-kaarten van cytoskelet-actinevezels verkregen in het gebied gemarkeerd door het rode vierkant in (B), waar de Z verticale posities van de verschillende actinefilamenten (rode pijlen) en de bovenste en onderste celmembranen worden gelijktijdig opgelost. De semitransparante afbeelding in het rode vierkant in (B) komt overeen met de 2D-projectie van de 3D-kaarten weergegeven in (C) en (D). Krediet:Wetenschappelijke vooruitgang , 10.1126/sciadv.abj4990
2D nano-endoscopie-AFM
Het vermogen om een lange nanosonde vele malen in een cel in te brengen met behoud van de levensvatbaarheid van de cellen impliceerde het potentieel om de top van de sonde in een levende cel te lokaliseren om lokale 2D/3D AFM-metingen uit te voeren zonder substantiële schade. De nanosonde zou in de cel kunnen worden ingebracht om de cytoplasmatische kant van het celmembraan te meten via amplitudemodulatie-modus AFM. De nanosondes moesten lang genoeg zijn om de cel volledig binnen te dringen en de bodem te bereiken, terwijl ze dun genoeg moesten zijn om celbeschadiging te verminderen. Om dit in de praktijk te bereiken, hebben Penedo et al. ontwikkelde nanosondes gemaakt van amorfe koolstof met behulp van elektronenstraaldepositie en maten de amplitude-afhankelijkheid van de afstand om de integriteit van de cel te bepalen. Ze voerden 2D nano-endoscopie-AFM-experimenten uit met behulp van een fibroblastcel om de reticulaire structuur van het binnenste celmembraan te illustreren en observeerden de celarchitectuur om de interne dynamiek van celstructuren te bestuderen. Het werk benadrukte de mogelijkheid om 2D nano-endoscopie-AFM te gebruiken om de nanodynamica van interne structuren in levende cellen onder fysiologische omgevingen te bestuderen.

2D nano-endoscopie-AFM techniek. (A) Illustratie van de 2D-nanoendoscopie-AFM-methode, waarbij de nanosonde in de cel wordt ingebracht om de cytoplasmatische kant van het celmembraan te meten door amplitudemodulatie-modus AFM. (B) voorbeeld van een door EBD vervaardigde nanosonde die wordt gebruikt in 2D nano-endoscopie-AFM, waarbij de lengte van de naald lang genoeg moet zijn om de cel volledig te penetreren en het onderste deel te bereiken en dun genoeg om de celbeschadiging te verminderen. (C) Opgenomen kracht (boven) en amplitude (onder) versus afstandscurven om de bovenste en onderste celmembranen nauwkeurig te lokaliseren:de verticale kracht is nul wanneer de nanosonde ver weg is, en neemt toe zodra de nanosonde het bovenste celmembraan raakt; daarna presenteert het een plateau dat overeenkomt met het interne cytoplasmatische domein totdat de curve weer scherp toeneemt wanneer de nanosonde het onderste celmembraan bereikt. Het amplitude-instelpunt voor de afstandsregeling van de tip-sample moet laag genoeg zijn om ervoor te zorgen dat de tip tegen het celbodemoppervlak tikt. (F) opeenvolgende 2D nano-endoscopie-AFM 1 m × 1 m afbeeldingen uitgevoerd op een BALB / 3T3-fibroblast op het gebied gemarkeerd door de rode stip afgebeeld in (D), met de reticulaire structuur van het binnenoppervlak van het celmembraan dat de steiger vormt en ook de membraanfluctuaties tijdens de metingen. (G) Ingezoomd gebied van de afbeeldingen weergegeven in (F), waarbij een sectie wordt uitgezet tussen de punten A en B (E), waar twee uitsteeksels gescheiden door 25 nm duidelijk in de afbeelding worden opgelost. Krediet:Wetenschappelijke vooruitgang , 10.1126/sciadv.abj4990
Vooruitzichten
Op deze manier toonden Marcos Penedo en collega's de toepassingen van nano-endoscopie-AFM om cytoplasmatische binnenoppervlakken van celmembranen en bijbehorende steigers te meten om de 3D-rangschikking van actinefilamenten in hun natuurlijke intracellulaire omgeving in levende cellen te begrijpen. Het team probeerde celbeschadiging te minimaliseren door ultradunne naaldachtige nanosondes in de experimenten te gebruiken. De voorgestelde AFM-methoden produceerden 3D-kaarten van interne celstructuren naast 2D-projecties in combinatie met bestaande fluorescentiemethoden zoals confocale of superresolutiemicroscopie. De methode zal licht werpen op celmachines in actie, in vivo, terwijl fysiologische moleculaire motoren worden blootgelegd. De methode opent ook nieuwe mogelijkheden om intracellulaire nanomechanica te bestuderen die een belangrijke rol spelen in cellulaire functies. Het team kan de methode gebruiken om de stijfheid, adhesie en dissipatiekenmerken van de kern te meten om biologische informatie te extraheren die geschikt is voor interdisciplinaire gebieden van celbiologie en geneeskunde. + Verder verkennen
Nieuwe beeldvormingsmethode geeft een live kijkje in hoe cellen werken
© 2022 Science X Network
 Duitsers zijn voorstander van een snelle stopzetting van het gebruik van steenkool naarmate het besluit nadert
Duitsers zijn voorstander van een snelle stopzetting van het gebruik van steenkool naarmate het besluit nadert 10 manieren om uw boodschappenlijst groener te maken
10 manieren om uw boodschappenlijst groener te maken  Zes wolken die je moet kennen - en wat ze kunnen onthullen over het weer
Zes wolken die je moet kennen - en wat ze kunnen onthullen over het weer Nieuwe studie rangschikt gevaarlijke asteroïde-effecten van minst tot meest destructief
Nieuwe studie rangschikt gevaarlijke asteroïde-effecten van minst tot meest destructief Bespaar thuis regenwater met een vegetarische moestuin
Bespaar thuis regenwater met een vegetarische moestuin
Hoofdlijnen
- Wat zijn de voordelen van biodiversiteit?
- Hoge prijzen van dierlijke producten onderdeel van een vicieuze cirkel naar uitsterven
- Wetenschappers ontwikkelen nieuwe techniek om vlees te kweken in het laboratorium met behulp van magnetisch veld
- Welke oorzaken smeren bij elektroforese?
- Wat is een IQ van een persoon?
- Wat zijn enkele kenmerken van DNA?
- Wedstrijden om vrouwelijke aandacht maken van mannen betere presteerders - in fruitvliegjes
- 10 fascinerende feiten over de nieuwe levensboom-evolutiekaart
- De voordelen van Stained Bacteria
- Onderzoekers demonstreren infraroodlichtmodulatie met grafeen
- Hoe weet je wanneer een nanodeeltje uit vorm is?
- Onderzoekers gebruiken een synthetische antiferromagneet op nanoschaal om niet-lineaire spindynamiek in te schakelen

- Grafeen organische fotovoltaïsche, of, zullen joggers t-shirts op een dag hun mobiele telefoons van stroom voorzien?
- Startup schaalt grafeenproductie op ontwikkelt biosensoren en supercondensatoren

 Californische gigantische watertunnels winnen eerste cruciale goedkeuring
Californische gigantische watertunnels winnen eerste cruciale goedkeuring Rock Cycle-activiteiten voor studenten
Rock Cycle-activiteiten voor studenten De regering van Biden stelt voor het recht van Californië te herstellen om regels voor autovervuiling vast te stellen
De regering van Biden stelt voor het recht van Californië te herstellen om regels voor autovervuiling vast te stellen Beperking blootgelegd in veelbelovend kwantumcomputermateriaal
Beperking blootgelegd in veelbelovend kwantumcomputermateriaal NASA-ruimtevaartuig stuurde asteroïde puin weg in monstergrijper
NASA-ruimtevaartuig stuurde asteroïde puin weg in monstergrijper VS verdedigen fossiele brandstoffen op VN-klimaatvergadering
VS verdedigen fossiele brandstoffen op VN-klimaatvergadering Kansen en beperkingen van AI in klimaatmodellering
Kansen en beperkingen van AI in klimaatmodellering Nieuw onderzoek werpt een diepere kijk op de wolken van Venus
Nieuw onderzoek werpt een diepere kijk op de wolken van Venus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

