
Wetenschap
Theorie voorspelt nieuw type binding die nanodeeltjeskristallen samenvoegt
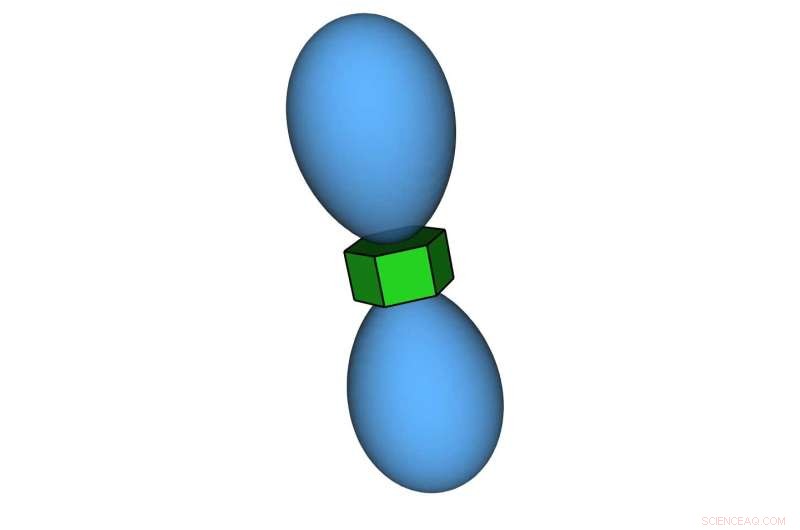
Nanodeeltjes in een prisma-orbitale vorm. De dichtheid van de pseudodeeltjes rond nanodeeltjesvormen lijkt op de elektronendichtheid in de elektronenorbitalen van atomen. Credit:Thi Vo, Glotzer Group, Universiteit van Michigan
Entropie, een fysieke eigenschap die vaak wordt uitgelegd als 'wanorde', wordt onthuld als een schepper van orde met een nieuwe bindingstheorie die is ontwikkeld aan de Universiteit van Michigan en gepubliceerd in de Proceedings of the National Academy of Sciences .
Ingenieurs dromen ervan nanodeeltjes te gebruiken om designermaterialen te bouwen, en de nieuwe theorie kan helpen bij de pogingen om nanodeeltjes samen te voegen tot bruikbare structuren. De theorie verklaart eerdere resultaten die de vorming van kristalstructuren door ruimtebeperkte nanodeeltjes onderzoeken, waardoor entropie kan worden gekwantificeerd en gebruikt in toekomstige inspanningen.
En merkwaardig genoeg weerspiegelt de reeks vergelijkingen die de interacties van nanodeeltjes als gevolg van entropie regelen, de vergelijkingen die chemische binding beschrijven. Sharon Glotzer, de Anthony C. Lembke Department Chair of Chemical Engineering, en Thi Vo, een postdoctoraal onderzoeker in de chemische technologie, beantwoordden enkele vragen over hun nieuwe theorie.
Wat is entropische binding?
Glotzer:"Entropische binding is een manier om uit te leggen hoe nanodeeltjes op elkaar inwerken om kristalstructuren te vormen. Het is analoog aan de chemische bindingen die door atomen worden gevormd. Maar in tegenstelling tot atomen zijn er geen elektroneninteracties die deze nanodeeltjes bij elkaar houden. In plaats daarvan ontstaat de aantrekkingskracht door entropie."
"Vaak wordt entropie geassocieerd met wanorde, maar het gaat echt om opties. Wanneer nanodeeltjes opeengepakt zijn en de opties beperkt zijn, blijkt de meest waarschijnlijke rangschikking van nanodeeltjes een bepaalde kristalstructuur te zijn. Die structuur geeft het systeem de meeste opties , en dus de hoogste entropie. Grote entropische krachten ontstaan wanneer de deeltjes dicht bij elkaar komen."
"Door de meest uitgebreide studies te doen naar deeltjesvormen en de kristallen die ze vormen, ontdekte mijn groep dat als je de vorm verandert, je de directionaliteit verandert van die entropische krachten die de vorming van deze kristalstructuren leiden. Die directionaliteit simuleert een binding, en omdat het wordt aangedreven door entropie, noemen we het entropische binding."
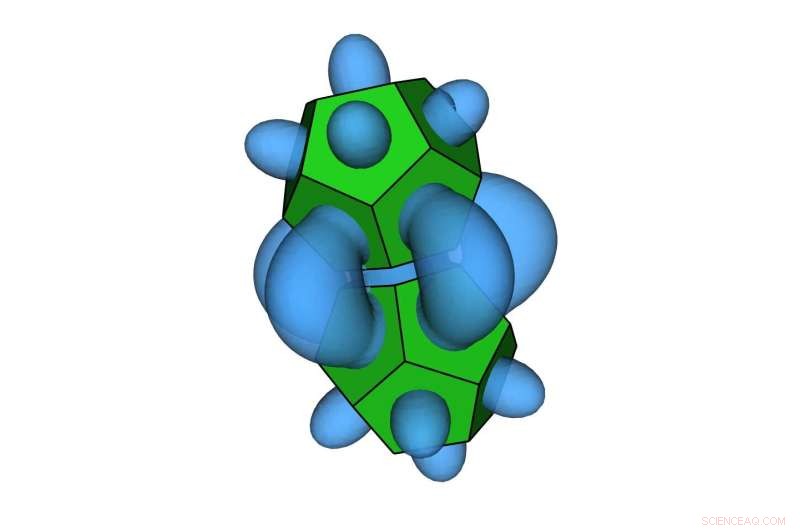
Nanodeeltjes in de vorm van een dodecaëder. Deze nieuwe manier om te begrijpen hoe entropie aantrekkingskracht tussen nanodeeltjes creëert, zou de ontwikkeling van nanomaterialen met ontworpen eigenschappen kunnen versnellen. Credit:Thi Vo, Glotzer Group, Universiteit van Michigan
Waarom is dit belangrijk?
Glotzer:"De bijdrage van Entropy aan het scheppen van orde wordt vaak over het hoofd gezien bij het ontwerpen van nanodeeltjes voor zelfassemblage, maar dat is een vergissing. Als entropie je systeem helpt zichzelf te organiseren, hoef je misschien geen expliciete aantrekkingskracht tussen deeltjes te ontwikkelen, bijvoorbeeld met behulp van DNA of andere kleverige moleculen - met een net zo sterke interactie als je dacht. Met onze nieuwe theorie kunnen we de sterkte van die entropische bindingen berekenen."
"Hoewel we wisten dat entropische interacties directionele bindingen kunnen zijn, is onze doorbraak dat we die bindingen kunnen beschrijven met een theorie die regel voor regel overeenkomt met de theorie die je zou opschrijven voor elektroneninteracties in echte chemische bindingen. diepgaand. Ik ben verbaasd dat het zelfs mogelijk is om dat te doen. Wiskundig gezien plaatst het chemische bindingen en entropische bindingen op dezelfde voet. Dit is zowel fundamenteel belangrijk voor ons begrip van materie als praktisch belangrijk voor het maken van nieuwe materialen. "
Elektronen zijn echter de sleutel tot die chemische vergelijkingen. Hoe deed je dit als er geen deeltjes de interacties tussen je nanodeeltjes bemiddelen?
Glotzer:"Entropie is gerelateerd aan de vrije ruimte in het systeem, maar jarenlang wist ik niet hoe ik die ruimte moest tellen. Dit grote inzicht was dat we die ruimte konden tellen met behulp van fictieve puntdeeltjes. En dat gaf ons de wiskundige analogie van de elektronen."
Vo:"De pseudodeeltjes bewegen door het systeem en vullen de ruimtes die moeilijk te vullen zijn voor een ander nanodeeltje - we noemen dit het uitgesloten volume rond elk nanodeeltje. Naarmate de nanodeeltjes meer geordend worden, wordt het uitgesloten volume eromheen kleiner, en de concentratie van pseudodeeltjes in die regio's neemt toe. De entropische bindingen zijn waar die concentratie het hoogst is."
"In drukke omstandigheden wordt de entropie die verloren gaat door de volgorde te vergroten, gecompenseerd door de entropie die wordt verkregen door het uitgesloten volume te verkleinen. Als gevolg hiervan zal de configuratie met de hoogste entropie degene zijn waar pseudodeeltjes de minste ruimte innemen." + Verder verkennen
Studie onthult hoe symmetrie in colloïdale kristallen kan worden doorbroken
 Een nieuw oplosmiddelsysteem:Hydrothermisch gesmolten zout
Een nieuw oplosmiddelsysteem:Hydrothermisch gesmolten zout Vroegtijdige in-vitrotests op nadelige effecten op embryo's
Vroegtijdige in-vitrotests op nadelige effecten op embryo's Q&A:Op weg naar een nieuwe manier om zonnecellen te produceren
Q&A:Op weg naar een nieuwe manier om zonnecellen te produceren Chemokinereceptor CX3CR1-structuren onthullen mechanisme van cholesterolregulatie bij activering
Chemokinereceptor CX3CR1-structuren onthullen mechanisme van cholesterolregulatie bij activering Wetenschappers maken biologisch afbreekbare microbeads van cellulose
Wetenschappers maken biologisch afbreekbare microbeads van cellulose
 Wat is het verschil tussen cumuluswolken en cirruswolken?
Wat is het verschil tussen cumuluswolken en cirruswolken?
In de meeste gevallen betekenen cirrus en cumuluswolken allebei mooi weer. Er zijn echter duidelijke verschillen tussen deze twee typen wolken, waaronder verschillen in hoogte en vorm. De La
 Hoe Mosquito Fish te kweken
Hoe Mosquito Fish te kweken  Koolstofstudie in Amazonewoud onthult inheemse gebieden, beschermde gebieden belegerd, toch de beste klimaatoplossing blijven
Koolstofstudie in Amazonewoud onthult inheemse gebieden, beschermde gebieden belegerd, toch de beste klimaatoplossing blijven Grootschalige klimaatopwarming kan de aanhoudende waas in Beijing vergroten
Grootschalige klimaatopwarming kan de aanhoudende waas in Beijing vergroten Mercurius van het noordelijk halfrond komt terecht in Australië
Mercurius van het noordelijk halfrond komt terecht in Australië
Hoofdlijnen
- Reconstructie van ijstijddiëten onthult ontrafelend levensweb
- Welke organismen voeren fotosynthese uit?
- Akoestische monitoring geeft een holistisch beeld van de biodiversiteit
- Doel van Cell Lysis Solution
- Hoe creëren de hersenen een ononderbroken kijk op de wereld?
- Onkruidverdelger veroorzaakt boze verdeeldheid onder Amerikaanse boeren
- Bloemen geheim signaal voor bijen en andere verbazingwekkende nanotechnologieën verborgen in planten
- Waarom zijn cellen belangrijk voor levende organismen?
- Team onthult regels voor het maken van ribben
- Sommige van onze voedingsmiddelen bevatten nanodeeltjes - moeten we ons zorgen maken?

- Magnetische beeldvorming op nanoschaal van ferritine in een enkele cel
- Nanometrisch afdrukken op vezel
- Onderzoekers bevorderen grafeen-spintronica met 1D-contacten om de mobiliteit van apparaten op nanoschaal te verbeteren
- Trillingsenergie het geheim van zelfaangedreven elektronica
 SpaceMat:Graphenes antwoord op de lancering van rubber voor recycling van banden op de markt
SpaceMat:Graphenes antwoord op de lancering van rubber voor recycling van banden op de markt Het belang van het verkleinen van een koolstofvoetafdruk
Het belang van het verkleinen van een koolstofvoetafdruk  Hera-asteroïde missies hersenen om stralingshard en storingsbestendig te zijn
Hera-asteroïde missies hersenen om stralingshard en storingsbestendig te zijn Onderzoekers identificeren nieuwe soorten prehistorische krokodil
Onderzoekers identificeren nieuwe soorten prehistorische krokodil Onafhankelijke muziek verpletterd uit streaming-afspeellijsten en inkomsten
Onafhankelijke muziek verpletterd uit streaming-afspeellijsten en inkomsten Uber-aandelen blijven dalen in eerste volledige handelsdag
Uber-aandelen blijven dalen in eerste volledige handelsdag Het hijab-effect:feministische reactie op moslimimmigranten in Duitsland
Het hijab-effect:feministische reactie op moslimimmigranten in Duitsland Hoeveel botten zitten er in een lichaam?
Hoeveel botten zitten er in een lichaam?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

