
Wetenschap
Magnetische beeldvorming op nanoschaal van ferritine in een enkele cel
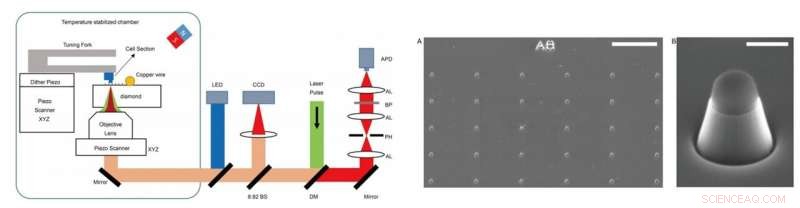
LINKS - Experimentele opstelling. Het experiment werd uitgevoerd op een zelfgebouwde opstelling, die optisch gedetecteerde magnetische resonantiemicroscopie (ODMR) combineerde met atomaire krachtmicroscopie (AFM). DM:dichroïsche spiegel. BP:banddoorlaatfilter werkt bij 650-775 nm. APD:lawine fotodiode. CCD:laadgekoppeld apparaat. LED:lichtgevende diode van 470 nm. AL:achromatische lens. PH:gaatje met een grootte van 30 m. BS:bundelsplitser. RECHTS - Afbeeldingen van de nanopilaren op diamanten. (A) SEM-beeldvorming van de gefabriceerde diamantnanopilaren net na reactief ionenetsen (RIE). De bovenkant van de nanopijler is bedekt met waterstofsilsesquioxaan (HSQ) om het NV-centrum te beschermen. (B) Een enkele trapeziumvormige cilindervormige nanopijler om celsecties te detecteren die aan de AFM-tip zijn vastgemaakt. Schaalbalken, 10 urn (A); 400 nm (B). Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aau8038.
In de levenswetenschappen, het vermogen om de verdeling van biomoleculen in een cel in situ te meten is een belangrijk onderzoeksdoel. Onder een verscheidenheid aan technieken, wetenschappers hebben magnetische beeldvorming (MI) op basis van het stikstofvacaturecentrum (NV) in diamanten gebruikt als een krachtig hulpmiddel in biomoleculair onderzoek. Echter, beeldvorming op nanoschaal van intracellulaire eiwitten is tot nu toe een uitdaging gebleven. In een recente studie die nu is gepubliceerd in wetenschappelijke vooruitgang , Pengfei Wang en collega's van de interdisciplinaire afdelingen natuurkunde, biomacromoleculen, kwantuminformatie en levenswetenschappen in China, gebruikte ferritine-eiwitten om de MI-realisatie van endogene eiwitten in een enkele cel aan te tonen, met behulp van het stikstof-leegstand (NV) centrum als sensor. Ze brachten intracellulaire ferritines en ferritine-bevattende organellen in beeld met behulp van MI en correlatieve elektronenmicroscopie om de weg vrij te maken voor magnetische beeldvorming (MI) op nanoschaal van intracellulaire eiwitten.
Het verhogen van de bestaande ruimtelijke resolutie van biomedische beeldvorming is vereist om aan de voortdurende eisen op het gebied van medische beeldvorming te voldoen, en daarom, tussen verschillende technieken, magnetische beeldvorming is momenteel van groot belang. Magnetische resonantiebeeldvorming (MRI) wordt veel gebruikt om de verdeling van kernspins te kwantificeren, maar conventionele MRI kan slechts een resolutie van 1 µm bereiken bij beeldvorming met kernspins waar de resolutie wordt beperkt door elektrische detectiegevoeligheid. Wetenschappers hebben een reeks technieken ontwikkeld om deze resolutiebarrière te doorbreken, inclusief een supergeleidend kwantuminterferentieapparaat en magnetische resonantiekrachtmicroscopie. Hoe dan ook, deze rapporten vereisen een cryogene omgeving en hoog vacuüm voor beeldvorming, beperking van de experimentele implementatie en de vertaling ervan naar de klinische praktijk.
Een recent ontwikkelde kwantumdetectiemethode op basis van het stikstofvacaturecentrum in diamant heeft de grens van MI-technieken op nanoschaal radicaal verlegd om organische moleculen en eiwitten in het laboratorium te detecteren. Wetenschappers hebben kwantumdetectie gecombineerd met NV-centra en scanning-sondemicroscopie om MRI op nanoschaal te demonstreren voor enkelvoudige elektronenspin en kleine nucleaire spin-ensemble, terwijl ze het NV-centrum gebruiken als een biocompatibele magnetometer om ferromagnetische deeltjes in cellen op subcellulaire schaal (0,4 m) niet-invasief af te beelden. Bijvoorbeeld, depolarisatie van het NV-centrum kan worden gebruikt als een breedbandmagnetometer om fluctuerende ruis van metaalionen en kernspins te detecteren en te meten. Echter, dergelijke beeldvorming van enkele eiwitten via MI op nanoschaal is tot nu toe niet gerapporteerd in de enkele cel.
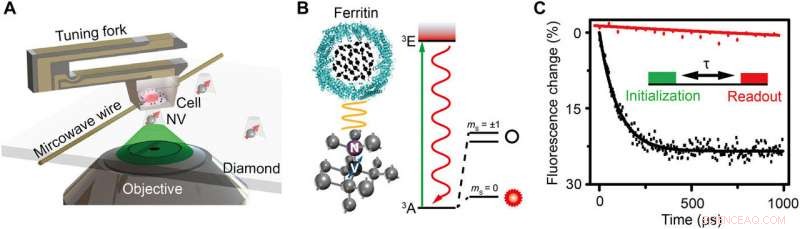
Schema van de opstelling en het experimentele principe. (A) Schematische weergave van de experimentele opstelling. De cel ingebed in hars is bevestigd aan een stemvork en scant boven de diamanten nanopilaar die een ondiep NV-centrum bevat. Een koperdraad wordt gebruikt om de microgolfpuls aan het NV-centrum te leveren. Een groene laser (532 nm) van de confocale microscoop (CFM) wordt gebruikt om initialiseren, en lees het NV-centrum uit. (B) Links:Kristalrooster en energieniveau van het NV-centrum. Het NV-centrum is een puntdefect dat bestaat uit een vervangend stikstofatoom en een aangrenzende vacature in diamant. Rechts:Schematische weergave van een ferritine. De zwarte pijlen geven de elektronenspins van Fe3+ aan. (C) Experimentele demonstratie van de detectie van spinruis met en zonder ferritine in de vorm van polarisatieverval voor hetzelfde NV-centrum. De inzet is de pulssequentie voor detectie en beeldvorming van het ferritine. Een groene laser van 5 s wordt gebruikt om de spintoestand te initialiseren op ms =0, gevolgd door een vrije evolutietijd τ om de magnetische ruis te accumuleren, en tenslotte wordt de spintoestand uitgelezen door de fluorescentie-intensiteit te detecteren. De pulsreeks wordt ongeveer 105 keer herhaald om een goede signaal-ruisverhouding (SNR) te verkrijgen. De relaxatietijd is aangepast op 0,1 en 3,3 ms door exponentieel verval voor het geval met en zonder ferritine, respectievelijk, wat wijst op een spinruis van 0,01 mT2. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aau8038.
In het huidige werk, Wang et al. rapporteerde twee technische vorderingen om MI op nanoschaal van intracellulaire eiwitten in een enkele cel mogelijk te maken. Voor deze, ze hebben de cel in een vaste toestand gefixeerd en ingewikkeld gesegmenteerd tot een kubusvorm, plaatste het vervolgens op een stemvork-scansonde van een atomaire krachtmicroscoop (AFM) voor beeldvorming, waar de vlakke dwarsdoorsnede van de cel werd blootgesteld aan lucht. De wetenschappers gebruikten de opstelling van de monsterplaatsing om de NV-sensor binnen 10 nm van de doeleiwitten te plaatsen en gebruikten de AFM om thermische drift te onderdrukken tijdens de positionering van het monster. Vervolgens ontwikkelden ze trapeziumvormige cilindervormige nanopilaren op een bulk diamantoppervlak voor beeldacquisitie, technisch verkorten van de tijd van beeldacquisitie met één bestelling in vergelijking met eerdere methoden. In de huidige studie, de wetenschappers gebruikten deze techniek om in situ MI uit te voeren van het magnetische fluctuerende geluid van intracellulaire ferritine-eiwitten (een biomarker van ijzervoorraden en transferrineverzadiging in het lichaam) binnen de experimentele opstelling.
Ferritine is een bolvormig eiwitcomplex met een buitendiameter van 12 nm, met een holte met een diameter van 8 nm die het mogelijk maakt om tot 4500 ijzeratomen in het eiwit op te slaan. De magnetische ruis van de ferri-ionen kan worden gedetecteerd vanwege hun effecten op de T 1 ontspanningstijd van een NV-centrum. In dit werk, Wang et al. bevestigde de waarneming met behulp van fluorescentiemetingen van tijdsafhankelijk verval van de populatie van NV-centra (magnetische spin, m S =0 staat), in een diamantoppervlak bedekt met ferritines. Aanvullend, de wetenschappers ontdekten de magnetische ruis met labelvrije methoden met behulp van het NV-centrum via transmissie-elektronenmicroscopie (TEM). The work allowed the development of a correlated MI and TEM scheme to obtain and verify the first nanoscale MI of a protein in situ.
The scientists used the hepatic carcinoma cell line (HepG2) for the experiments and studied iron metabolism by treating the cells with ferric ammonium citrate (FAC), which significantly increased the amount of intracellular ferritin. They verified this using confocal microscopy (CFM), western blotting and TEM techniques at first. The results showed the primary localization of ferritins in the intracellular puncta around the nucleus, among the cytoplasm. The scientists used bulk electron paramagnetic resonance (EPR) spectroscopy to confirm the paramagnetic properties of ferritin in the FAC-treated HepG2 cells and mass spectroscopy to measure the interference due to other paramagnetic metal ions.
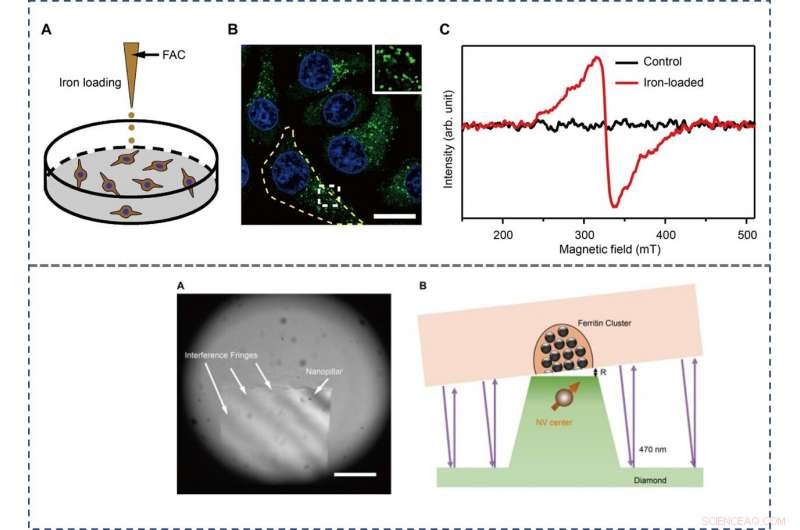
TOP - The preparation and characterization of ferritin-rich HepG2 cell samples. (A) Schematic view of the treatment to cultured cells. Following iron loading or no treatment, the HepG2 cells were examined for fluorescence images and EPR spectra, respectievelijk. For the MI and TEM imaging, cell samples were treated through high-pressure freezing, freeze substitution, and sectioning. (B) Representative confocal microscopy (CFM) image of ferritin structures (green) in iron-loaded HepG2 cells. The ferritin proteins were immunostained by anti-ferritin light chain antibody. The nuclei are indicated by 4′, 6-diamidino-2-phenylindole (DAPI) in the blue channel. Inset displays magnified ferritin structures. The yellow dashed line outlines the contour of a cell. Schaalbalk, 20 μm. (C) EPR spectra of control and iron-loaded HepG2 cells at T =300 K. BOTTOM - Adjusting the distance between the NV center and the cell section. (A) Interference fringes between the cell cube and the diamond surface. Schaalbalk, 20 μm. (B) The geometric relation and the gap R between cell samples and diamond-pillars for MI. The top surface diameter of the nanopillar is 400 nm. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
Wang et al. then used ultrafast, high-pressure freezing to immobilize all intracellular components of the Fe-loaded cells. The process stabilized the intracellular structures and molecules by minimizing Brownian motion in cells, which typically contributes to random motion of proteins up to 100 nm in vivo. To image the samples, they embedded and polymerized the frozen cells in LR White medium, followed by gluing the embedded cell sample to the AFM tuning fork with a few cells at the tip. Using a diamond knife, the scientists then sectioned the tip surface to nanometer flatness to examine the cuboid cell section under AFM. They acquired MI images of ferritins by scanning the cell cube along the diamond nanopillars and simultaneously measured NV spin repolarization rate using the "leapfrog" scanning mode of the microscope as detailed previously.
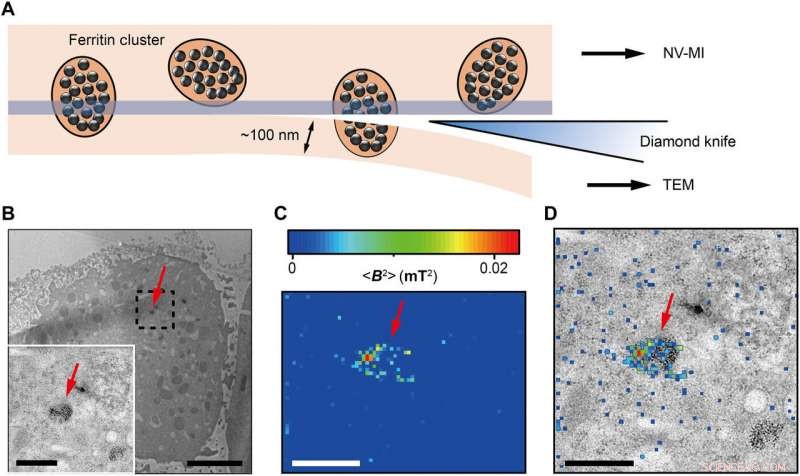
Correlative MI and TEM images. (A) Schematic view of sectioning for correlative MI and TEM imaging. The last section and the remaining cube were transferred for TEM imaging and MI scanning, respectievelijk. The sectioning resulted in some split ferritin clusters that could be imaged under both microscopes. A transparent blue strip of ~10 nm indicates the imaging depth of the MI, while in the TEM, the imaging depth is ~100 nm. (B) Distribution of ferritins from the last ultrathin section under TEM. Inset:Magnified figure of the part in black dashed box. (C) MI result of the remaining cell cube. The pixel size is 43 nm. (D) The merged MI and TEM micrograph shows ferritins in a membrane-bound organelle. The red arrows in (B) to (D) indicate the same ferritin cluster. Scale bars, 5 μm (B) and 1 μm [B (inset), C, and D]. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
The scientists measured fluorescence decay at a fixed free evolution time of 50 microseconds (τ =50 μs) to reveal the degree of NV sensor spin polarization, which correlated with the amount of ferritin in the sensing volume. They observed the appearance of some clusters via both TEM and MI images, although some details were not observed in MI, the results confirmed that spin noise from intracellular ferritin contributed to depolarize the NV center. In order to obtain details of the ferritin clusters at higher resolution, the scientists minimized the pixel size to 8.3 nm and acquired MI of high resolution of the proteins as expected.
Op deze manier, Wang et al. explored the sensitivity of NV centers as an appropriate sensor for biological imaging applications at the level of the single molecule. They used the technique as a sensor in the experimental setup to obtain the first MI of a protein at a resolution of 10 nm in situ. The scientists aim to improve the stability and sensitivity of the technique to speed up the scanning process and image a larger area of interest in the cell and locate ferritin beyond the nucleus in association with additional organelles.
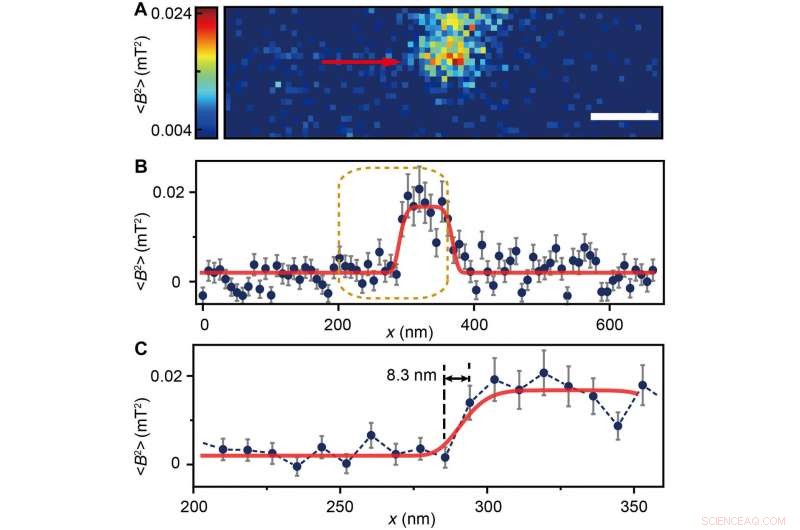
(A) Ferritin cluster imaged by the NV sensor with 80 × 24 pixels and a pixel size of 8.3 nm. Schaalbalk, 100 nm. (B) Trace data of the scanning line in (A) directed by the red arrow. The platform indicates the ferritin cluster. The red curve fitted by a plateau function serves as a guide to the eye. (C) Magnified figure of the gold dashed box in (B). The sharp transition indicated by the red arrow around x =283 nm shows the scanning from the blank area to the area with ferritins. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
The work will contribute to clinical diagnostics to determine biomarker-based iron storage and release in cells. This will include studies on the regulatory mechanisms of iron metabolism during the progression of hemochromatosis, anemia, liver cirrhosis and Alzheimer's disease. Wang et al. propose to extend the approach in situ to other cellular components with paramagnetic signals, including magnetic molecules, metalloproteins and special spin-labelled proteins. The scientists envision that further studies will explore additional targets suitable for high-resolution MI and correlated TEM imaging techniques, with optical microscopy detection incorporated to the experimental setup to extend the work and determine protein nuclear spin MRI as well as perform three-dimensional cell tomography.
© 2019 Wetenschap X Netwerk
 Schade veroorzaakt door een Tornado
Schade veroorzaakt door een Tornado Poll:Rampen beïnvloeden denken over klimaatverandering
Poll:Rampen beïnvloeden denken over klimaatverandering Regio Sydney wordt geconfronteerd met catastrofale dreiging van bosbranden
Regio Sydney wordt geconfronteerd met catastrofale dreiging van bosbranden MABI-instrument kan de concentratie en bron van zwarte koolstofvervuiling in de atmosfeer bepalen
MABI-instrument kan de concentratie en bron van zwarte koolstofvervuiling in de atmosfeer bepalen Klimaatkosten het laagst als opwarming beperkt blijft tot 2 graden Celsius
Klimaatkosten het laagst als opwarming beperkt blijft tot 2 graden Celsius
Hoofdlijnen
- Waarom het uitsterven van parasieten een probleem kan zijn voor bedreigde woylies
- Verschil tussen transcriptie en DNA-replicatie
- Chloroplasten zijn de plantencellen die energie produceren
- Wie geeft er om WA-uilen?
- Is er een psychologische reden waarom mensen gemeen zijn op internet?
- Mieren in het bladerdak van het Amazone-regenwoud hebben veel meer bacteriën in hun ingewanden dan grondbewoners
- Wat bevindt zich aan de linkerkant van uw lichaam in menselijke anatomie?
- Wat is de functie van een eicel?
- Wat eerst kwam,
- Fotovoltaïsche energie van elke halfgeleider

- Gouden nanopijlen vormen de basis van exotische nieuwe superstructuren

- Team rapporteert schaalbare fabricage van zelf-uitgelijnde grafeentransistors, circuits

- Tiny nanomachine voltooit testrit met succes

- Koolstof nanospike-katalysator splitst water, koolstofdioxide en recombineert atomen tot zwaardere nanokoolstoffen

 Microfluïdische array-vangsten, houdt enkele cervicale cellen vast voor snellere screening
Microfluïdische array-vangsten, houdt enkele cervicale cellen vast voor snellere screening Voors en tegens van waterhergebruik
Voors en tegens van waterhergebruik  Een nieuwe interpretatie van petrogenese van de vroege continentale korst van de aarde
Een nieuwe interpretatie van petrogenese van de vroege continentale korst van de aarde Nanomateriaal maakt laserlicht beter toepasbaar
Nanomateriaal maakt laserlicht beter toepasbaar Tweede golf COVID-19 in Myanmar zorgt voor dramatische toename van armoede
Tweede golf COVID-19 in Myanmar zorgt voor dramatische toename van armoede Groot, kristallijne lipide-scaffolds bieden nieuwe mogelijkheden voor eiwitten, drugsonderzoek
Groot, kristallijne lipide-scaffolds bieden nieuwe mogelijkheden voor eiwitten, drugsonderzoek Hoe werkt een parachute?
Hoe werkt een parachute?  Komt naar een monitor bij u in de buurt:Een storingsvrij, molecuul-dikke film
Komt naar een monitor bij u in de buurt:Een storingsvrij, molecuul-dikke film
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

