
Wetenschap
Chemokinereceptor CX3CR1-structuren onthullen mechanisme van cholesterolregulatie bij activering
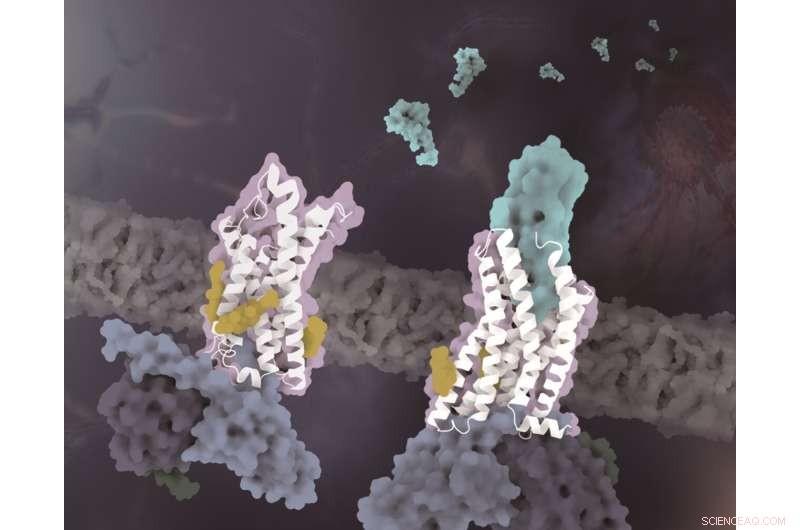
De structuren van CX3CR1 in verschillende conformationele toestanden. De CX3CR1 in zowel ligandvrije toestand als CX3CL1-gebonden toestand zijn wit gekleurd. De CX3CL1 is cyaan gekleurd, de cholesterolen zijn geel gekleurd en de drie subeenheden van het G-eiwit zijn respectievelijk lichtblauw, donkerblauw en donkergroen gekleurd. Credit:Zhao Qiang's laboratorium bij SIMM
Chemokinereceptoren reguleren de migratie van immuuncellen en zijn betrokken bij ontstekingen, tumoropbouw en infectie met pathogenen. Chemokines zijn onderverdeeld in vier subfamilies volgens het aantal en de verdeling van geconserveerde cysteïnen aan het N-uiteinde:CC, CXC, CX3C en XC.
De chemokinen herkennen hun receptoren in dezelfde subfamilie, wat de gerichte ontwikkeling van geneesmiddelen bemoeilijkt. Als het enige lid van de CX3C-chemokinereceptorsubfamilie, biedt CX3CR1 een uniek voordeel als een potentieel medicijndoelwit bij de behandeling van atherosclerose, kanker en neuropathie. De geneesmiddelontwikkeling van CX3CR1 wordt echter gedeeltelijk belemmerd door het gebrek aan structurele informatie die de herkenning van chemokines en receptoractivering regelt.
In een studie gepubliceerd in Science Advances op 29 juni maakte een onderzoeksteam onder leiding van Zhao Qiang en Wu Beili van het Shanghai Institute of Materia Medica (SIMM) van de Chinese Academie van Wetenschappen een doorbraak op het gebied van chemokinereceptoren door de cryo-elektronenmicroscopiestructuren van CX3CR1 op te lossen -Gi- en CX3CR1-CX3CL1-Gi-complexen.
Hoewel verschillende chemokine-receptorcomplexstructuren in de CC- en CXC-subfamilies zijn opgelost, blijft het moleculaire mechanisme van de unieke herkenning van CX3CR1 en CX3CL1 onbekend. Met de analyse van structuren en sequentie-uitlijning ontdekten de onderzoekers dat de unieke structurele kenmerken van de 30s-lus in CX3CL1 en het ECL2-gebied in CX3CR1 een sleutelrol spelen bij de herkenning met vormcomplementariteitsmechanisme. Vergeleken met de CC- en CXC-chemokinen resulteert het specifieke CX3C-motief van CX3CL1 in een grotere verschuiving van de 30s-lus naar de CX3CR1 ECL2.
Omdat de ECL2 van CX3CR1 minder residuen bevat dan andere chemokinereceptoren, biedt de kortere ECL2 in de CX3CR1-CX3CL1-structuur dienovereenkomstig voldoende ruimte voor de 30s-lus van CX3CL1. De 30s-lus van andere chemokine-subfamilies vertoont echter een niet-verlengde conformatie, die complementair is aan het oppervlak van langere ECL2 van de overeenkomstige receptoren.
Dit is de eerste keer dat wetenschappers de structurele basis hebben geleverd voor het ophelderen van het moleculaire mechanisme van specifieke herkenning tussen CX3CR1 en zijn unieke endogene ligand.
Naast de specificiteit van chemotactische signaalherkenning, onthult een andere belangrijke bevinding van deze studie dat cholesterolmoleculen de activering van CX3CR1 reguleren. In de complexe structuren van zowel CX3CL1-gebonden als constitutief geactiveerde toestanden, werd waargenomen dat drie cholesterolen de helix VI van CX3CR1 stabiliseren met een veel kleinere conformationele verandering dan eerder opgeloste klasse A GPCR-Gi-complexstructuren. Ondersteund door functionele gegevens van CX3CR1 en andere chemokinereceptoren, wordt verder geverifieerd dat de cholesterolen een specifiek essentiële rol spelen bij conformatiestabilisatie en signaaltransductie van CX3CR1.
Deze studie geeft inzicht in het unieke chemokine-herkenningsmechanisme voor de subfamilie van de humane chemokinereceptor. De verschillende cholesterolbindingsplaatsen van CX3CR1 verdiepen onze kennis over de modulatie van cholesterolen in GPCR's. + Verder verkennen
Wetenschappers maken doorbraak in begrip serotoninereceptoren
 Eenvoudig en leuk chemische reactie-experimenten
Eenvoudig en leuk chemische reactie-experimenten  Wetenschappers ontwerpen moleculair systeem voor kunstmatige fotosynthese
Wetenschappers ontwerpen moleculair systeem voor kunstmatige fotosynthese PDGFR-kinaseremmer blijkt te beschermen tegen septische dood via regulering van BTLA
PDGFR-kinaseremmer blijkt te beschermen tegen septische dood via regulering van BTLA Biochemici onthullen inzichten in buitengewoon regeneratief vermogen
Biochemici onthullen inzichten in buitengewoon regeneratief vermogen Leuke manieren om periodiek te leren leren
Leuke manieren om periodiek te leren leren
 Nieuw onderzoek voorspelt de toekomst van koraalriffen onder klimaatverandering
Nieuw onderzoek voorspelt de toekomst van koraalriffen onder klimaatverandering De oorsprong van de Andes ontrafeld
De oorsprong van de Andes ontrafeld Modelbiascorrecties voor betrouwbare projectie van extreme El Niño-frequentieverandering
Modelbiascorrecties voor betrouwbare projectie van extreme El Niño-frequentieverandering Voorspellers:orkaanseizoen wordt drukker dan eerst gedacht
Voorspellers:orkaanseizoen wordt drukker dan eerst gedacht Verschil tussen muggen- en zandvliegbeten
Verschil tussen muggen- en zandvliegbeten
Hoofdlijnen
- Wat zijn de vier organische moleculen die in levende wezens worden gevonden?
- Vier van de vijf pinyon-jeneverbes boomsoorten die in hun verspreidingsgebied in het westen afnemen
- Video:De aanval van invasieve soorten overleven
- Hoe beïnvloedt DNA-replicatie je lichaam?
- Onderzoek onthult hoe cellen zich herbouwen na mitose
- Difference Between Gap Junctions & Plasmodesmata
- De circadiane klok bepaalt het tempo van de plantengroei
- DNA-modellen maken met behulp van papier
- Wat is een IQ van een persoon?
- Onderzoekers zetten niet-giftige resten om in coating die slijtvast is, vlek en zonlicht

- Zeemosselen zijn een model voor het verbeteren van kracht, rekbaarheid en hechting in hydrogels voor wondgenezing

- De zich snel ontvouwende toekomst van slimme stoffen

- Laten we de vloeistof-vloeistof-interface onder ogen zien

- Wetenschapsexperimenten over pH-niveaus

 Doorbrekende symmetrie leidt tot responsieve organische fotodetectoren
Doorbrekende symmetrie leidt tot responsieve organische fotodetectoren Bedrijven profiteren van het geven van getuigenissen van het congres, studie vondsten
Bedrijven profiteren van het geven van getuigenissen van het congres, studie vondsten Een nieuw meetrecord voor het sterkste magnetische veld in het universum
Een nieuw meetrecord voor het sterkste magnetische veld in het universum Hoe 24 getallen te nemen en alle combinaties
Hoe 24 getallen te nemen en alle combinaties Bijna 50 mensen naar ziekenhuizen na tornado Texas
Bijna 50 mensen naar ziekenhuizen na tornado Texas Nieuw onderzoek benadrukt de noodzaak om te leren van klimaatveranderingen uit het verleden
Nieuw onderzoek benadrukt de noodzaak om te leren van klimaatveranderingen uit het verleden Nieuwe methode zou een genezend licht kunnen schijnen op de hersenen voor mensen met bewegingsstoornissen
Nieuwe methode zou een genezend licht kunnen schijnen op de hersenen voor mensen met bewegingsstoornissen Science Fair-projecten op kauwgom
Science Fair-projecten op kauwgom
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

