
Wetenschap
Ingenieurs ontwikkelen nanodeeltjes die de bloed-hersenbarrière passeren
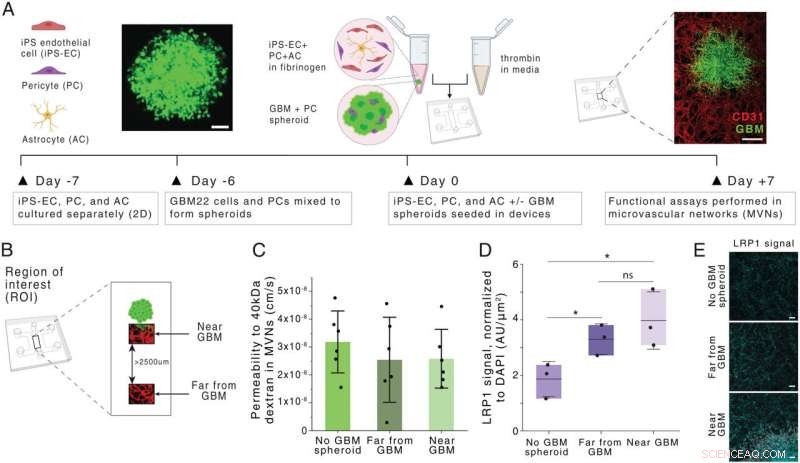
Generatie en karakterisering van een glioblastoom BBB MVN-model (BBB-GBM-model). (A) Schematische voorstelling van BBB-GBM vorming in een microfluïdische apparaat. (Schaalbalken:100 m [Links] en 500 m [Rechts].) (B) ROI's ruimtelijk geïdentificeerd binnen het BBB-GBM-model, met verre van GBM ROI's geïdentificeerd als ten minste 2500 m verwijderd van de GBM-sferoïde. (C) Permeabiliteit voor 40-kDa dextran in de vasculaire netwerken over verschillende ROI-locaties; elk punt vertegenwoordigt n =1 apparaat. (D) Expressie van LRP1 over verschillende ROI-locaties, zoals beoordeeld via immunofluorescentiekleuring; elk punt vertegenwoordigt n =1 apparaat. (E) Representatieve microfoto's van LRP1-kleuring gekwantificeerd in D. (Schaalbalken:100 m.) In alle grafieken vertegenwoordigen staven gemiddelde ± SD. ns, niet significant. *P <0,05. Statistische analyses worden beschreven in Materialen en Methoden. AU, willekeurige eenheden; 2D, tweedimensionaal. Credit:Procedures van de National Academy of Sciences (2022). DOI:10.1073/pnas.2118697119
Er zijn momenteel weinig goede behandelingsopties voor glioblastoom, een agressieve vorm van hersenkanker met een hoog sterftecijfer. Een van de redenen dat de ziekte zo moeilijk te behandelen is, is dat de meeste chemotherapiemedicijnen de bloedvaten rond de hersenen niet kunnen binnendringen.
Een team van MIT-onderzoekers ontwikkelt nu medicijndragende nanodeeltjes die efficiënter in de hersenen lijken te komen dan medicijnen die alleen worden gegeven. Met behulp van een door hen ontworpen menselijk weefselmodel, dat nauwkeurig de bloed-hersenbarrière repliceert, toonden de onderzoekers aan dat de deeltjes in tumoren kunnen komen en glioblastoomcellen kunnen doden.
Veel potentiële glioblastoombehandelingen hebben succes opgeleverd in diermodellen, maar faalden vervolgens in klinische onderzoeken. Dit suggereert dat er een beter soort modellering nodig is, zegt Joelle Straehla, de Charles W. en Jennifer C. Johnson Clinical Investigator bij MIT's Koch Institute for Integrative Cancer Research, een instructeur aan de Harvard Medical School en een kinderoncoloog bij Dana-Farber Kanker Instituut.
"We hopen dat we, door deze nanodeeltjes in een veel realistischer model te testen, veel tijd en energie kunnen besparen die verloren gaan door dingen in de kliniek te proberen die niet werken", zegt ze. "Helaas zijn er voor dit type hersentumor honderden onderzoeken geweest met negatieve resultaten."
Straehla en Cynthia Hajal, een postdoc bij Dana-Farber, zijn de hoofdauteurs van de studie, die deze week verschijnt in de Proceedings of the National Academy of Sciences . Paula Hammond, professor aan het MIT Institute, hoofd van de afdeling Chemical Engineering en lid van het Koch Institute; en Roger Kamm, de Cecil en Ida Green Distinguished Professor of Biological and Mechanical Engineering, zijn de senior auteurs van het artikel.
De bloed-hersenbarrière modelleren
Enkele jaren geleden begon Kamms lab te werken aan een microfluïdisch model van de hersenen en de bloedvaten die de bloed-hersenbarrière vormen.
Omdat de hersenen zo'n vitaal orgaan zijn, zijn de bloedvaten rondom de hersenen veel restrictiever dan andere bloedvaten in het lichaam, om potentieel schadelijke moleculen buiten te houden.
Om die structuur in een weefselmodel na te bootsen, groeiden de onderzoekers van de patiënt afgeleide glioblastomacellen in een microfluïdisch apparaat. Vervolgens gebruikten ze menselijke endotheelcellen om bloedvaten te laten groeien in kleine buisjes rond de bol van tumorcellen. Het model omvat ook pericyten en astrocyten, twee celtypen die betrokken zijn bij het transport van moleculen door de bloed-hersenbarrière.
Terwijl Hajal aan dit model werkte als een afgestudeerde student in het laboratorium van Kamm, kwam ze in contact met Straehla, toen een postdoc in het laboratorium van Hammond, die geïnteresseerd was in het vinden van nieuwe manieren om de toediening van nanodeeltjes aan de hersenen te modelleren. Het krijgen van medicijnen door de bloed-hersenbarrière is van cruciaal belang voor het verbeteren van de behandeling van glioblastoom, dat meestal wordt behandeld met een combinatie van chirurgie, bestraling en de orale chemotherapie temozolomide. Het overlevingspercentage van vijf jaar voor de ziekte is minder dan 10 procent.
Het laboratorium van Hammond pionierde met een techniek die laag-voor-laag assemblage wordt genoemd, waarmee ze nanodeeltjes met een oppervlaktefunctionaliteit kunnen maken die medicijnen in hun kern dragen. De deeltjes die de onderzoekers voor dit onderzoek hebben ontwikkeld, zijn gecoat met een peptide genaamd AP2, waarvan in eerder werk is aangetoond dat het nanodeeltjes helpt door de bloed-hersenbarrière te komen. Zonder nauwkeurige modellen was het echter moeilijk om te bestuderen hoe de peptiden hielpen bij het transport door bloedvaten en in tumorcellen.
Toen de onderzoekers deze nanodeeltjes afleverden aan weefselmodellen van zowel glioblastoma als gezond hersenweefsel, ontdekten ze dat de met het AP2-peptide gecoate deeltjes veel beter de bloedvaten rond de tumoren konden penetreren. Ze toonden ook aan dat het transport plaatsvond door binding aan een receptor genaamd LRP1, die overvloediger is in de buurt van tumoren dan in normale hersenvaten.
De onderzoekers vulden de deeltjes vervolgens met cisplatine, een veelgebruikt medicijn voor chemotherapie. Toen deze deeltjes werden gecoat met het targeting-peptide, waren ze in staat om glioblastoma-tumorcellen in het weefselmodel effectief te doden. Echter, deeltjes die de peptiden niet hadden, beschadigden uiteindelijk de gezonde bloedvaten in plaats van zich op de tumoren te richten.
"We zagen een verhoogde celdood in tumoren die werden behandeld met het met peptide gecoate nanodeeltje in vergelijking met de naakte nanodeeltjes of het vrije medicijn. Die gecoate deeltjes vertoonden meer specificiteit om de tumor te doden, in plaats van alles op een niet-specifieke manier te doden", zegt Hajal.
Effectievere deeltjes
De onderzoekers probeerden vervolgens de nanodeeltjes aan muizen te leveren, met behulp van een gespecialiseerde chirurgische microscoop om de nanodeeltjes te volgen die door de hersenen bewegen. Ze ontdekten dat het vermogen van de deeltjes om de bloed-hersenbarrière te passeren erg leek op wat ze hadden gezien in hun menselijke weefselmodel.
Ze toonden ook aan dat gecoate nanodeeltjes met cisplatine de tumorgroei bij muizen konden vertragen, maar het effect was niet zo sterk als wat ze in het weefselmodel zagen. Dit kan zijn omdat de tumoren zich in een verder gevorderd stadium bevonden, zeggen de onderzoekers. Ze hopen nu andere medicijnen te testen, gedragen door een verscheidenheid aan nanodeeltjes, om te zien welke het grootste effect zou kunnen hebben. Ze zijn ook van plan om hun aanpak te gebruiken om andere soorten hersentumoren te modelleren.
"Dit is een model dat we zouden kunnen gebruiken om effectievere nanodeeltjes te ontwerpen", zegt Straehla. "We hebben slechts één type hersentumor getest, maar we willen dit echt uitbreiden en testen met veel andere, vooral zeldzame tumoren die moeilijk te bestuderen zijn omdat er mogelijk niet zoveel monsters beschikbaar zijn."
De onderzoekers beschreven de methode die ze gebruikten om het hersenweefselmodel te maken in een recente Nature Protocols papier, zodat andere laboratoria het ook kunnen gebruiken. + Verder verkennen
Een nanodeeltje en remmer triggeren het immuunsysteem en zijn hersenkanker te slim af
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Tropische storm Irwins oostelijke kant bouwt voort op satellietbeelden
Tropische storm Irwins oostelijke kant bouwt voort op satellietbeelden Een wandeling door de regenboog met PACE
Een wandeling door de regenboog met PACE Vertraging van de continentale plaatbeweging controleerde de timing van de grootste vulkanische gebeurtenissen op aarde
Vertraging van de continentale plaatbeweging controleerde de timing van de grootste vulkanische gebeurtenissen op aarde Het omzetten van voedselafval in diervoeder kan een deel van de uitstoot van vee wegnemen
Het omzetten van voedselafval in diervoeder kan een deel van de uitstoot van vee wegnemen Mythbusting:vijf veelvoorkomende misvattingen over de milieueffecten van plastic voor eenmalig gebruik
Mythbusting:vijf veelvoorkomende misvattingen over de milieueffecten van plastic voor eenmalig gebruik
Hoofdlijnen
- Wat is de eerste stap in een polymerasekettingreactie?
- Vroege mensen gepaard met ingeteelde neanderthalers - tegen een prijs
- Hittetolerante broccoli voor de toekomst
- Wat zijn de belangrijkste functies van microtubules in de cel?
- Nieuwe ontdekking daagt lang gekoesterde evolutietheorie uit
- Vreemde ondernemingen:mierenkoninginnen begraven doden om ziekte te voorkomen
- Meer dan 1,1 miljoen zeeschildpadden gestroopt in de afgelopen drie decennia:studie
- In het laboratorium gekweekte hersenorganoïden slimmer maken
- De adelaars scouten:het bewijs dat het beschermen van nesten de voortplanting bevordert
- Nieuwe hybride microscoop biedt ongeëvenaarde mogelijkheden
- Nanosubs krijgen betere fluorescerende eigenschappen voor tracking
- Experimenten bevestigen dat lichtknijpende 2D-exciton-polaritonen kunnen bestaan

- Koolstof nanobuisjes bootsen biologie na

- Team kraakt code te goedkoop, kleine koolstof nanobuisjes

 De begraven wetlands van de wereld terugbrengen uit de dood
De begraven wetlands van de wereld terugbrengen uit de dood Juiste cover-crop-mix goed voor zowel Chesapeake als bottom-lines
Juiste cover-crop-mix goed voor zowel Chesapeake als bottom-lines Amazone, Walmart handelt weerhaken op belastingen, loon
Amazone, Walmart handelt weerhaken op belastingen, loon Bosch-ingenieurs richten zich op het opfleuren van de toekomst van diesel
Bosch-ingenieurs richten zich op het opfleuren van de toekomst van diesel Voetbal met Frobenius: The Super Bowl Math Problem
Voetbal met Frobenius: The Super Bowl Math Problem Roemeen die Warcraft aanviel krijgt jaar cel
Roemeen die Warcraft aanviel krijgt jaar cel Kleurveranderende sensor detecteert tekenen van oogbeschadiging in tranen
Kleurveranderende sensor detecteert tekenen van oogbeschadiging in tranen De wortel van microplastics in planten
De wortel van microplastics in planten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

