
Wetenschap
Nano-eiwit corona verstoort de eiwithomeostase en hermodelleert het celmetabolisme
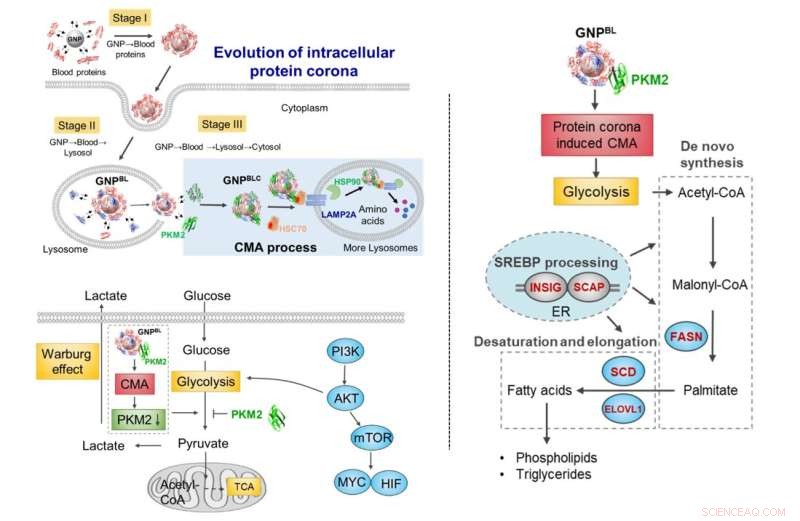
Evolutie van de nano-eiwit corona tijdens celtransport. Tijdens transport vanuit het bloed-lysosomaal-cytoplasma veroorzaakt de uitwisseling van componenten van de eiwitcorona met intracellulaire eiwitten (chaperoneiwitten, metabole kinasen) een toename van chaperonne-eiwit-gemedieerde autofagie-activiteit en hermodelleert selectief het celmetabolisme. Krediet:Chen Chunying et al.
Een onderzoeksteam onder leiding van prof. Chen Chunying van het National Center for Nanoscience and Technology (NCNST) van de Chinese Academie van Wetenschappen (CAS) heeft onlangs de evolutie van de nano-eiwitcorona tijdens endocytose en de verstoring ervan in de eiwithomeostase en cel onderzocht. metabolisme. Hun resultaten zijn gepubliceerd in PNAS .
Wanneer nanodeeltjes biologische systemen binnendringen, binden biomoleculen van biologische vloeistof zich snel aan het oppervlak van de nanodeeltjes. De nano-eiwitcorona die als startstap wordt gevormd door interactie met eiwitmoleculen in het bloed, heeft een enorme impact op het transport en het lot van de nanodeeltjes. Hoe de vorming van de nano-eiwitcorona de herkenning, het transport, de distributie, de functie en de biologische effecten van nanodeeltjes in de weefsels en cellen van verschillende barrièresystemen beïnvloedt, is een "zwarte doos" voor medische toepassing van nanomaterialen, die niet alleen de levering beperkt efficiëntie van nanogeneeskunde, maar tast ook de effectiviteit en veiligheid ernstig aan.
Een belangrijke uitdaging op dit gebied is de complexiteit van de nano-eiwitcorona, die wordt beïnvloed door de diversiteit van biomoleculen in verschillende weefsels en organen, evenals door fysiologische en pathologische toestanden. Op dit moment is er dringend behoefte om te begrijpen hoe de eiwitsamenstelling en structurele kenmerken van de eiwitcorona evolueren binnen biologische micro-omgevingen.
Om dit probleem op te lossen, hebben de onderzoekers het dynamische evolutiepatroon van de eiwitsamenstelling van de nano-eiwit-corona in het proces van celtransport onthuld door de innovatieve toepassing van multidimensionale multi-omics (proteomics, metabolomics, lipidomics), intermoleculaire interacties , en in situ massaspectrometrie beeldvorming.
Met gouden nanodeeltjes als model werd het dynamische evolutieproces van de eiwitcorona van het bloedsysteem naar het intracellulaire (bloed-lysosomaal-cytoplasma) bestudeerd. Wanneer de nanodeeltjes vanuit de bloedomgeving via endocytose in het lysosoom werden geplaatst en vervolgens uit het lysosoom in het cytoplasma ontsnapten, zou de eiwitsamenstelling op het oppervlak van de nanodeeltjes drastisch veranderen. De meeste werden vervangen door intracellulaire eiwitmoleculen, waarbij slechts een deel van de in de bloedomgeving gevormde eiwitcoronacomponenten werd behouden.
Vervolgens zorgde de intracellulaire evolutie van de nano-eiwit-corona niet alleen voor een verstoorde intracellulaire eiwithomeostase (proteostase), maar veroorzaakte ook de verrijking van chaperonne-eiwitten (HSC70, HSP90) en pyruvaatkinase M2 (PKM2) op het oppervlak van de intracellulaire nano-corona, en gestimuleerde chaperonne-gemedieerde autofagie. Het beïnvloedde verder de celglycolyse, veroorzaakte veranderingen in het celenergiemetabolisme en reguleerde het cellipidemetabolismeproces.
Deze studie verheldert het evolutionaire patroon van nanodeeltjes van bloed naar een subcellulaire micro-omgeving, en identificeert de specificiteit van de intracellulaire micro-omgeving van nano-eiwit corona, waardoor het celmetabolisme wordt hervormd. Het biedt ook theoretische ondersteuning voor een diepgaand begrip van de complexe biologische effecten van nanomaterialen en regulering van nanobiotische interfaces. + Verder verkennen
De effecten van eiwitcorona op de interacties van AIE-gevisualiseerde liposomen met ce
 Om de landbouw klimaatvriendelijker te maken, koolstoflandbouw heeft duidelijke regels nodig
Om de landbouw klimaatvriendelijker te maken, koolstoflandbouw heeft duidelijke regels nodig Beperkte reikwijdte van duurzaam ondernemen onthuld
Beperkte reikwijdte van duurzaam ondernemen onthuld Eerste wereldonderzoek vindt 9, 600 boomsoorten dreigen uit te sterven
Eerste wereldonderzoek vindt 9, 600 boomsoorten dreigen uit te sterven Verlies van intergetijdenecosysteem legt kustgemeenschappen bloot
Verlies van intergetijdenecosysteem legt kustgemeenschappen bloot Wanhopige race tegen branden in 's werelds grootste tropische wetlands
Wanhopige race tegen branden in 's werelds grootste tropische wetlands
Hoofdlijnen
- Alles wat je nooit wilde weten over bedwantsen, en meer
- Een ezelsverhaal:Nigeria wordt de belangrijkste exporthub voor verstoppingen
- Nieuwe methode voor het planten van citrusvruchten stopt insecten, levert extra voordelen op
- Hoe een celmodel te maken met Playdough
- De relatie tussen leeftijd en plasticiteit
- Is het Ida-fossiel de ontbrekende schakel?
- Meer dan 75 procent afname van de totale biomassa van vliegende insecten in 27 jaar
- Welke genen en genomen onthullen over onze gezondheid
- Veranderingen in mariene ecosystemen blijven onopgemerkt
- Methode voor het doorbreken van symmetrie in feedbackgestuurde zelfassemblage van optische metamaterialen

- Tests tonen aan dat kristalsoom nanodeeltje langer meegaat in de bloedbaan

- Afdrukbaar bionisch oor versmelt elektronica en biologie
- Proces bedacht voor ultradunne koolstofmembranen

- Draagbare apparaten aangedreven door lichaamsbeweging met behulp van rekbare dunne films van koolstof nanobuisjes

 Grafeen mapping 50 keer sneller
Grafeen mapping 50 keer sneller PoseRBPF:een nieuw deeltjesfilter voor het volgen van 6D-objecten
PoseRBPF:een nieuw deeltjesfilter voor het volgen van 6D-objecten Eerste structuur van volledige lengte van GLP-1-receptor gebonden aan peptide-agonist
Eerste structuur van volledige lengte van GLP-1-receptor gebonden aan peptide-agonist Social Status-calculator laat zien in welke klas je zou zijn geweest in de tijd van Shakespeare
Social Status-calculator laat zien in welke klas je zou zijn geweest in de tijd van Shakespeare Onderzoek naar radiologische misdrijven:wetenschapper-detectives stellen zichzelf op de proef
Onderzoek naar radiologische misdrijven:wetenschapper-detectives stellen zichzelf op de proef Hoe afstand van licht te berekenen
Hoe afstand van licht te berekenen  Carnegie Mellon biedt nieuwe major voor kunstmatige intelligentie
Carnegie Mellon biedt nieuwe major voor kunstmatige intelligentie Warmte, overstromingen, branden:jetstream belangrijke schakel bij klimaatrampen
Warmte, overstromingen, branden:jetstream belangrijke schakel bij klimaatrampen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

