
Wetenschap
Nanodeeltjes:het complexe ritme van de chemie
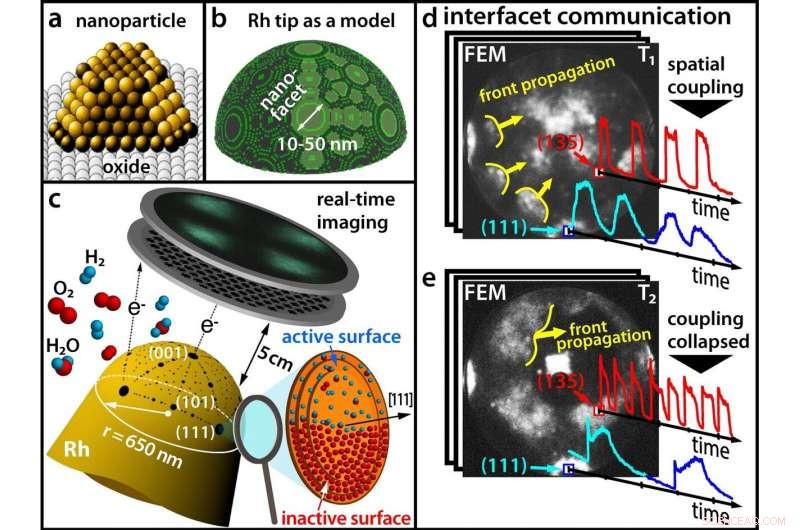
(a) Moderne katalysatoren bestaan uit nanodeeltjes; (b) Een Rhodium-tip als model voor een nanodeeltje; (c) Een chemische reactie in realtime volgen met een veldemissiemicroscoop (d) Bij lage temperaturen, verschillende facetten oscilleren synchroon (e) Bij hogere temperaturen, synchroniciteit is verbroken. Krediet:Technische Universiteit Wenen
De meeste commerciële chemicaliën worden geproduceerd met behulp van katalysatoren. Gebruikelijk, deze katalysatoren bestaan uit minuscule metalen nanodeeltjes die op een oxidische drager worden geplaatst. Net als bij een geslepen diamant, waarvan het oppervlak bestaat uit facetten die in verschillende richtingen zijn georiënteerd, een katalytisch nanodeeltje heeft ook kristallografisch verschillende facetten - en deze facetten kunnen verschillende chemische eigenschappen hebben.
Tot nu, deze verschillen zijn in het katalyse-onderzoek vaak buiten beschouwing gebleven omdat het erg moeilijk is om tegelijkertijd informatie te verkrijgen over de chemische reactie zelf en over de oppervlaktestructuur van de katalysator. Aan de TU Wien (Wenen), dit is nu bereikt door verschillende microscopische methoden te combineren:Met behulp van veldelektronenmicroscopie en veldionenmicroscopie, het werd mogelijk om de oxidatie van waterstof op een enkel rhodium nanodeeltje in realtime te visualiseren met een resolutie van nanometers. Daarbij kwamen verrassende effecten aan het licht waarmee in de toekomst bij de zoektocht naar betere katalysatoren rekening moet worden gehouden. De resultaten zijn nu gepresenteerd in het wetenschappelijke tijdschrift Wetenschap .
Het ritme van chemische reacties
"Bij bepaalde chemische reacties, een katalysator kan periodiek heen en weer schakelen tussen een actieve en een inactieve toestand, " zegt prof. Günther Rupprechter van het Instituut voor Materiaalchemie van de TU Wien. "Zelfvoorzienende chemische oscillaties kunnen optreden tussen de twee toestanden - de chemicus Gerhard Ertl ontving de Nobelprijs voor de Scheikunde voor deze ontdekking in 2007."
Dit is ook het geval bij rhodium nanodeeltjes, die worden gebruikt als katalysator voor waterstofoxidatie - de basis van elke brandstofcel. Onder bepaalde omstandigheden, de nanodeeltjes kunnen oscilleren tussen een toestand waarin zuurstofmoleculen dissociëren op het oppervlak van het deeltje en een toestand waarin waterstof gebonden is.
Opgenomen zuurstof verandert het oppervlaktegedrag
"Wanneer een rhodiumdeeltje wordt blootgesteld aan een atmosfeer van zuurstof en waterstof, de zuurstofmoleculen worden aan het rhodiumoppervlak in afzonderlijke atomen gesplitst. Deze zuurstofatomen kunnen dan migreren onder de bovenste rhodiumlaag en zich daar ophopen als de ondergrondse zuurstof, " legt prof. Yuri Suchorski uit, de eerste auteur van de studie.
Door interactie met waterstof, deze opgeslagen zuurstofatomen kunnen dan weer naar buiten worden gehaald en reageren met waterstofatomen. Vervolgens, er is weer ruimte voor meer zuurstofatomen in het rhodiumdeeltje en de cyclus begint opnieuw. "Dit feedbackmechanisme regelt de frequentie van de trillingen, " zegt Yuri Suchorski.
Tot nu, men dacht dat deze chemische oscillaties altijd synchroon plaatsvonden in hetzelfde ritme over het hele nanodeeltje. Ten slotte, de chemische processen op de verschillende facetten van het nanodeeltjesoppervlak zijn ruimtelijk gekoppeld, aangezien de waterstofatomen gemakkelijk van het ene facet naar de aangrenzende facetten kunnen migreren.
Echter, de resultaten van de onderzoeksgroep van prof. Günther Rupprechter en prof. Yuri Suchorski laten zien dat de zaken eigenlijk veel complexer zijn:onder bepaalde voorwaarden, de ruimtelijke koppeling wordt opgeheven en aangrenzende facetten oscilleren plotseling met aanzienlijk verschillende frequenties - en in sommige gebieden van het nanodeeltje, deze oscillerende "chemische golven" planten zich helemaal niet voort.
"Dit kan worden verklaard op atomaire schaal, " zegt Yuri Suchorski. "Onder invloed van zuurstof, uitstekende rijen rhodiumatomen kunnen uit een glad oppervlak tevoorschijn komen." Deze rijen atomen kunnen dan fungeren als een soort "golfbreker" en de migratie van waterstofatomen van het ene facet naar het andere belemmeren - de facetten worden ontkoppeld.
Als dit de zaak is, de individuele facetten kunnen oscillaties van verschillende frequenties vormen. "Op verschillende facetten de rhodiumatomen zijn anders gerangschikt op het oppervlak, " zegt Günther Rupprechter. "Daarom verloopt de opname van zuurstof onder de verschillende facetten van het rhodiumdeeltje ook met verschillende snelheden, en zo resulteren oscillaties met verschillende frequenties op kristallografisch verschillende facetten."
A hemisphere tip as a nanoparticle model
The key to unraveling this complex chemical behavior lays in using a fine rhodium tip as a model for a catalytic nanoparticle. An electric field is applied, and due to the quantum mechanical tunneling effect, electrons can leave the tip. These electrons are accelerated in the electric field and hit a screen, where a projection image of the tip is then created with a resolution of around 2 nanometers.
In contrast to scanning microscopies, where the surface sites are scanned one after the other, such parallel imaging visualizes all surface atoms simultaneously—otherwise it would not be possible to monitor the synchronization and desynchronization of the oscillations.
The new insights into the interaction of individual facets of a nanoparticle can now lead to more effective catalysts and provide deep atomic insights into mechanisms of non-linear reaction kinetics, pattern formation and spatial coupling.
Hoofdlijnen
- Een model van een menselijke cel bouwen
- Hoe goed kennen mensen zichzelf eigenlijk?
- Zijn mannen gewelddadiger dan vrouwen?
- Kenmerken van micro-organismen
- Maak een lijst van de 3 stappen die optreden tijdens de interfase
- Malariaparasiet verpakt genetisch materiaal voor reis van muggen naar mensen
- Complexere biologische systemen evolueren vrijer
- Onderzoekers ontdekken hoe planten op moleculair niveau reageren op veranderingen in licht
- Honden en wolven delen parasieten
- Onderzoekers gebruiken oxiden om de geleidbaarheid van grafeen om te draaien

- Een nieuwe manier om wrijving te meten tussen sterk geordende pyrolytische grafietmaterialen
- Fluorescentie-simkaart verkrijgbaar bij EMSL:een krachtig instrument om moleculaire celbiologie te bestuderen, inclusief synthetische biologie
- Groen licht voor ultrafijne weergavekleuren

- Toekomstige flexibele elektronica op basis van koolstofnanobuizen:verbetering van de prestaties van nanobuistransistors met fluorpolymeren

 Econoom:heropenen van een geïnfecteerde economie is geen kortere weg naar financieel herstel
Econoom:heropenen van een geïnfecteerde economie is geen kortere weg naar financieel herstel NASA ziet een goed gedefinieerd centrum in overblijfselen van Ex-Tropical Depression 02Ws
NASA ziet een goed gedefinieerd centrum in overblijfselen van Ex-Tropical Depression 02Ws Het internationale ruimtestation 20 biedt hoop en een sjabloon voor toekomstige samenwerking
Het internationale ruimtestation 20 biedt hoop en een sjabloon voor toekomstige samenwerking Nieuw elektrisch fenomeen op nanoschaal ontdekt
Nieuw elektrisch fenomeen op nanoschaal ontdekt Patronen van bevolkingsgroei in een ecosysteem
Patronen van bevolkingsgroei in een ecosysteem  Met sterren bezaaide afbeelding van het Sextans B-dwergstelsel toont astronomische bezienswaardigheden dichtbij en ver weg
Met sterren bezaaide afbeelding van het Sextans B-dwergstelsel toont astronomische bezienswaardigheden dichtbij en ver weg Onderzoekers ontwikkelen overstromingsvoorspellingsmodel
Onderzoekers ontwikkelen overstromingsvoorspellingsmodel Niet-levende dingen in een bosecosysteem
Niet-levende dingen in een bosecosysteem
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com


