
Wetenschap
Zebravisembryo's helpen te bewijzen wat er met nanodeeltjes in het bloed gebeurt
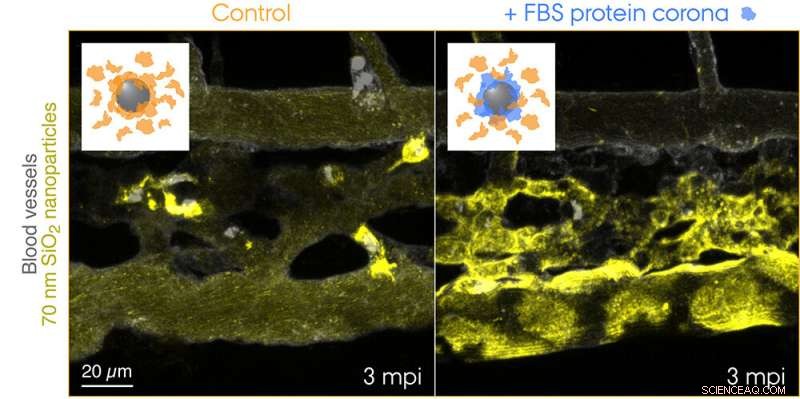
Fluorescerend gelabelde 70 nm SiO2-nanodeeltjes werden in de bloedbaan van 3 dagen oude transgene zebravisembryo's geïnjecteerd en 3 minuten na de injectie live in beeld gebracht. De inzetstukken tonen schema's voor de twee geteste omstandigheden:controle nanodeeltjes met een corona van endogene eiwitten (oranje) en nanodeeltjes met een voorgevormde corona van foetaal runderserum (FBS) eiwitten (blauw) en aanvullende endogene eiwitten. Controle nanodeeltjes worden snel opgevangen door macrofagen, terwijl de nanodeeltjes met een niet-zelf biologische identiteit effectief worden afgezonderd door endotheelcellen van de aaseter. Krediet:Yuya Hayashi. Aangepast van Mohammad-Beigi et al. (2020) ACS Nano. Copyright 2020 American Chemical Society
Een verscheidenheid aan nanodeeltjes is ontworpen voor gerichte medicijnafgifte, maar helaas bereikt slechts een zeer klein deel van de geïnjecteerde nanodeeltjes de doellocatie, zoals solide tumoren. De reden achter de lage targeting-efficiëntie wordt vaak als een "zwarte doos" beschouwd en was daarom jarenlang weinig onderzocht.
Onlangs, een internationaal onderzoeksteam onder leiding van Yuya Hayashi van de afdeling Moleculaire Biologie en Genetica (MBG), Universiteit van Aarhus, demonstreerde de schoonheid van zebravisembryo's in nano-bio-imaging die dynamische interacties tussen nanodeeltjes en cellen van belang in een levend organisme kan visualiseren (zie een ander artikel "Zebravissen laten je het biologische lot van nanodeeltjes in vivo zien").
Nutsvoorzieningen, samenwerken met onderzoekers van het Interdisciplinair Nanoscience Center (iNANO), Yuya probeert onopgeloste mysteries in de bionanowetenschap te beantwoorden - de eerste in de rij is het biologische identiteitsconcept, wat verklaart hoe cellen nanodeeltjes herkennen via een "corona" van eiwitten die elk deeltje omringen. Dit concept is nu voor het eerst bewezen in een levend organisme door het gebruik van zebravisembryo's die blootleggen wat er gebeurt met nanodeeltjes die in het bloed worden geïnjecteerd.
Vriend of vijand? Hoe biologische systemen nanodeeltjes herkennen
"What the Cell Sees in Bionanoscience" is een van de eerste publicaties die heeft gedefinieerd hoe een corona van eiwitten zich rond een nanodeeltje vormt en hoe zo'n eiwitcorona de noodzaak impliceert om de manier waarop we naar nanodeeltjes in een biologisch milieu kijken te heroverwegen. Uit uitgebreid onderzoek in het afgelopen decennium, we begrijpen nu dat twee tegengestelde effecten voornamelijk bijdragen aan de opname van nanodeeltjes door cellen. In het algemeen, de eiwitcorona voorkomt dat het oppervlak van de nanodeeltjes directe fysieke interacties aangaat met het celmembraan. Echter, wat als de eiwitcorona een signaal geeft dat een specifieke biologische interactie veroorzaakt met receptoren die op het celmembraan zijn geplaatst? Dat is iets wat de cel ziet en zo een biologische identiteit aan het nanodeeltje verleent.
Nu hebben de onderzoekers van de Universiteit van Aarhus zo het eerste "visuele" bewijs geleverd voor de opvallende bijdrage van de eiwitcorona aan de verwijdering van nanodeeltjes uit het bloed, wat nadelige resultaten met zich meebracht in het zebravisembryomodel. Het onderzoeksteam gebruikte een soort-niet-overeenkomende bron van eiwitten voor de corona-vorming om een "niet-zelf" biologische identiteit te creëren en volgde de reis van nanodeeltjes die door het bloed reizen en naar hun eindbestemming - endolysosomen in de cel. Dit onthulde een verrassend snelle opname en verzuring van de nanodeeltjes door endotheelcellen van de aaseter (functioneel equivalent aan de sinusoïdale endotheelcellen van de lever bij zoogdieren), gevolgd door pro-inflammatoire activering van macrofagen (zie de film op de webpagina van Yuya's groep).
"Het klinkt als een gek idee om nanodeeltjes te injecteren met eiwitten van een ander dier, " zegt Yuya, "maar bijv. op biomoleculen geïnspireerde nanomedicijnen worden getest in een muismodel zonder bijzondere zorgen voor de soort-niet-overeenkomende combinatie. Of een paar slimme mensen vermenselijken de muis om het probleem met de compatibiliteit van soorten op te lossen. In feite, zelfs op celcultuurniveau worden nanodeeltjes nog steeds routinematig getest volgens de traditie om serumsupplementen te gebruiken die afkomstig zijn van koeien, terwijl we weten dat interacties tussen nanodeeltjes en eiwitten een belangrijke drijfveer zijn voor cellulaire opname."
"Wat dit soort experimenten nogal uitdagend maakt, is, " voegt eerste auteur Hossein Mohammad-Beigi toe, "om de oorspronkelijke eiwitcorona maximaal te behouden in een levend organisme. Als de voorgevormde corona snel wordt uitgewisseld door endogene bloedeiwitten, de geteste hypothese ongeldig wordt. We hebben behoorlijk wat inspanningen geleverd om de eiwitcorona te karakteriseren om ervoor te zorgen dat de nanodeeltjes de niet-zelf-biologische identiteit behouden."
Zien is geloven - het zebravismodel kan bieden wat knaagdiermodellen niet kunnen
Het grootste voordeel van het zebravismodel is zijn kracht in realtime meerkleurenbeeldvorming, waarbij meerdere combinaties van fluorescentie-tracers en reporter-eiwitten in een eenvoudige opstelling kunnen worden afgebeeld met een hoge spatio-temporele resolutie. Dit biedt een nieuwe kans die ligt tussen minder realistische celkweeksystemen en meer uitdagende knaagdierexperimenten zoals intravitale microscopie.
"Met behulp van celculturen, we hebben heel veel geleerd over hoe cellen nanodeeltjes herkennen in plaats van dynamische aggregaten van eiwitten, maar het is nooit getest in een meer realistische situatie, Yuya legt uit. "Met de oprichting van het zebravismodel, we hebben eindelijk een middel gekregen om deze vraag verder te onderzoeken in een levend organisme. Het was een eenvoudige aanpak met een extreem scenario getest in een zeer complex systeem, maar ik geloof dat we nu een stap dichter bij het begrijpen zijn wat de eiwitcorona echt kan betekenen voor nanodeeltjes. In een omgeving die rijk is aan eiwitten, nanodeeltjes kunnen een masker dragen dat hen een biologische identiteit geeft, en zijn niet-zelfzucht kan hen tot een vijand maken. Wat bepaalt de mate van niet-zelfzucht? We zullen, het is de volgende grote vraag die we moeten beantwoorden."
 Metalen gebruiken als brandstof
Metalen gebruiken als brandstof Nieuw flexibel materiaal verandert zijn poreuze aard bij blootstelling aan licht
Nieuw flexibel materiaal verandert zijn poreuze aard bij blootstelling aan licht Wetenschappers ontwikkelen enzym geproduceerd uit landbouwafval voor gebruik als wasmiddel
Wetenschappers ontwikkelen enzym geproduceerd uit landbouwafval voor gebruik als wasmiddel De suikercode ontcijferen
De suikercode ontcijferen Surrey ontwikkelt nieuwe superkatalysator om koolstofdioxide en methaan te recyclen
Surrey ontwikkelt nieuwe superkatalysator om koolstofdioxide en methaan te recyclen
 De grootste uitstervingsgebeurtenis op aarde kostte waarschijnlijk eerst planten
De grootste uitstervingsgebeurtenis op aarde kostte waarschijnlijk eerst planten Econoom zegt dat een toename van het aantal zeer warme dagen de productiviteit zal verminderen en de gezondheidsrisico's zal vergroten
Econoom zegt dat een toename van het aantal zeer warme dagen de productiviteit zal verminderen en de gezondheidsrisico's zal vergroten Wetenschappers passen vingerafdruktest toe voor CO2-opslag
Wetenschappers passen vingerafdruktest toe voor CO2-opslag NASA werpt een dubbel oog op orkaan Flossie
NASA werpt een dubbel oog op orkaan Flossie Meerjarig onderzoek in onderzeeër-canyon daagt leerboektheorieën over troebelheidsstromen uit
Meerjarig onderzoek in onderzeeër-canyon daagt leerboektheorieën over troebelheidsstromen uit
Hoofdlijnen
- Studie analyseert de eigenaardige schedelanatomie van brulapen
- Kunnen we onze organen klonen voor gebruik bij een transplantatie?
- Wat zijn enkele materialen die ik zou kunnen gebruiken om plantencellen te maken?
- Is het DNA tussen genen echt rommel?
- Music Science Fair Project Ideas
- DNA-sequentiebepaling: definitie, methoden, voorbeelden
- Het verschil tussen prokaryotische en eukaryotische genexpressie
- Leven gelukkige mensen langer?
- Vier grote groepen organische verbindingen die levende organismen samenstellen
- Kleine nanodeeltjes zorgen voor grote verbetering van medische beeldvorming
- 3D-printer met nano-precisie

- Zinkoxide-microdraden verbeteren de prestaties van lichtemitterende diodes

- Nieuwe studie onthult nieuwe technologie voor plasmascheiding met behulp van magneten
- Onderzoekers meten temperatuur op nanometerschaal

 Orkaan Sally treft Amerikaanse Golfkust
Orkaan Sally treft Amerikaanse Golfkust NASA's nieuwe Marsrover zal röntgenstralen gebruiken om op fossielen te jagen
NASA's nieuwe Marsrover zal röntgenstralen gebruiken om op fossielen te jagen Science Fair Projecten over het verschil tussen zand en potgrond Waterabsorptie
Science Fair Projecten over het verschil tussen zand en potgrond Waterabsorptie Tesla stijgt te midden van hoge verwachtingen van zonne-energie
Tesla stijgt te midden van hoge verwachtingen van zonne-energie Menselijk din verdrinkt de natuur stil,
Menselijk din verdrinkt de natuur stil,  Stanford-ingenieurs perfectioneren koolstofnanobuisjes voor zeer energiezuinig computergebruik
Stanford-ingenieurs perfectioneren koolstofnanobuisjes voor zeer energiezuinig computergebruik EU onderzoekt Duitse autofabrikanten op mogelijke collusie
EU onderzoekt Duitse autofabrikanten op mogelijke collusie Definanciering van de politie:oproepen niet gemakkelijk overdraagbaar naar andere sectoren zonder aanzienlijke uitgaven, aanpassingen
Definanciering van de politie:oproepen niet gemakkelijk overdraagbaar naar andere sectoren zonder aanzienlijke uitgaven, aanpassingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

