
Wetenschap
Licht en nanotechnologie gecombineerd om biofilms op medische implantaten te voorkomen

Afbeelding van de chirurgische implantaten, bedekt met gouden nanodeeltjes (stapel mazen aan de linkerkant) in vergelijking met de originele chirurgische mazen voorafgaand aan de behandeling (stapel mazen aan de rechterkant). Krediet:ICFO
Ongeveer 50 jaar geleden uitgevonden, chirurgische medische meshes zijn sleutelelementen geworden in de herstelprocedures van operaties aan beschadigd weefsel, de meest voorkomende is hernia-reparatie. Wanneer geïmplanteerd in het weefsel van de patiënt, het flexibele en aanpasbare ontwerp van deze mazen helpt de spieren strak te houden en stelt patiënten in staat veel sneller te herstellen dan bij conventionele zaai- en hechtoperaties.
Echter, het inbrengen van een medisch implantaat in het lichaam van een patiënt brengt het risico met zich mee van bacteriële contaminatie tijdens de operatie en de daaropvolgende vorming van een infectieuze biofilm over het oppervlak van het chirurgische gaas. Dergelijke biofilms hebben de neiging zich te gedragen als een ondoordringbare coating, het belemmeren van elk soort antibioticum om de bacteriën op de film te bereiken en aan te vallen om de infectie te stoppen. Dus, antibiotica therapieën, die in de tijd beperkt zijn, zou kunnen falen tegen deze superresistente bacteriën en de patiënt zou kunnen eindigen in terugkerende operaties die zelfs tot de dood kunnen leiden. Eigenlijk, volgens het European Antimicrobial Resistance Surveillance Network (EARS-Net), in 2015 meer dan 30, 000 sterfgevallen in Europa werden in verband gebracht met infecties met antibioticaresistente bacteriën.
Vroeger, er zijn verschillende benaderingen gezocht om implantaatcontaminatie tijdens chirurgie te voorkomen. Er zijn aseptische protocollen na de operatie opgesteld en geïmplementeerd om deze antibioticaresistente bacteriën te bestrijden, maar geen enkele heeft de rol van het oplossen van dit probleem volledig vervuld.
In een recente studie gepubliceerd in Nano-letters en gemarkeerd in Natuurfotonica , ICFO-onderzoekers dr. Ignacio de Miguel, Arantxa Albornoz, onder leiding van ICREA Prof. bij ICFO Romain Quidant, in samenwerking met onderzoekers Irene Prieto, Dr. Vanesa Sanz, Dr. Christine Weis en Dr. Pau Turon van het grote bedrijf voor medische hulpmiddelen en farmaceutische hulpmiddelen B. Braun, hebben een nieuwe techniek bedacht die nanotechnologie en fotonica gebruikt om de prestaties van medische meshes voor chirurgische implantaten drastisch te verbeteren.
Door een voortdurende samenwerking sinds 2012, het team van onderzoekers van ICFO en B. Braun Surgical, SA, ontwikkelde een medisch gaas met een bijzonder kenmerk:het oppervlak van het gaas werd chemisch gemodificeerd om miljoenen gouden nanodeeltjes te verankeren. Waarom? Omdat is bewezen dat gouden nanodeeltjes licht zeer efficiënt omzetten in warmte op zeer gelokaliseerde gebieden.

SEM-microfoto's van de S. aureus biofilm gevormd op het oppervlak van het chirurgische gaas. Krediet:ICFO
De techniek om gouden nanodeeltjes in licht-warmte-omzettingsprocessen te gebruiken, was in eerdere studies al getest bij kankerbehandelingen. Nog meer, bij ICFO was deze techniek geïmplementeerd in verschillende eerdere studies ondersteund door de Cellex Foundation, dus een ander treffend voorbeeld van hoe vroege visionaire filantropische steun, gericht op het aanpakken van fundamentele problemen, uiteindelijk leidt tot belangrijke praktische toepassingen. Voor dit specifieke geval, in de wetenschap dat er wereldwijd meer dan 20 miljoen herniaoperaties per jaar plaatsvinden, ze geloofden dat deze methode de medische kosten bij terugkerende operaties zou kunnen verminderen, terwijl de dure en ineffectieve antibioticabehandelingen die momenteel worden gebruikt om dit probleem aan te pakken, worden geëlimineerd.
Dus, in hun in-vitro-experiment en via een grondig proces, het team bedekte het chirurgische gaas met miljoenen gouden nanodeeltjes, spreid ze gelijkmatig over de hele structuur. Ze testten de mazen om de stabiliteit van de deeltjes op lange termijn te garanderen, de niet-afbraak van het materiaal, en het niet loslaten of vrijkomen van nanodeeltjes in de omgeving (kolf). Ze konden een homogene verdeling van de nanodeeltjes over de structuur waarnemen met behulp van een scanning elektronenmicroscoop.
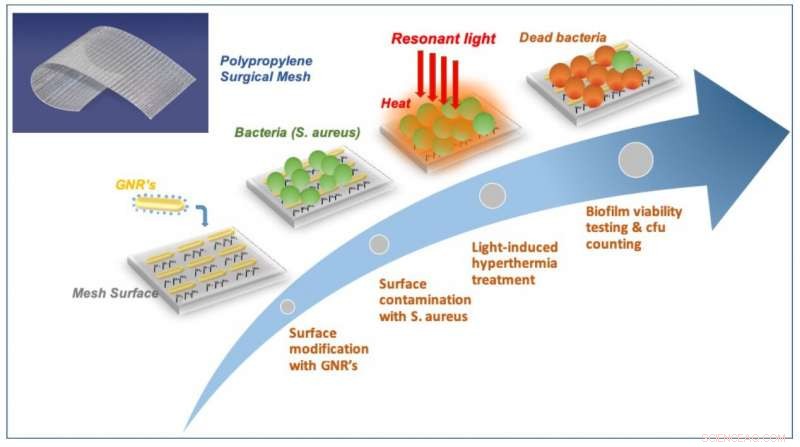
Schematische weergave van plasmon-enabled biofilmpreventie op chirurgische mazen. Krediet:ICFO
Toen de aangepaste mesh klaar was, het team stelde het gedurende 24 uur bloot aan S.aureus-bacteriën totdat ze de vorming van een biofilm op het oppervlak observeerden. Vervolgens, ze begonnen het gaas gedurende 30 seconden bloot te stellen aan korte intense pulsen van nabij-infrarood licht (800 nm) om ervoor te zorgen dat thermisch evenwicht werd bereikt, voordat u deze behandeling 20 keer herhaalt met tussenpozen van 4 seconden rust tussen elke puls. Ze ontdekten het volgende:Ten eerste, ze zagen dat het verlichten van het gaas met de specifieke frequentie gelokaliseerde oppervlakteplasmonresonanties in de nanodeeltjes zou induceren - een modus die resulteert in de efficiënte omzetting van licht in warmte, het verbranden van de bacteriën aan de oppervlakte. Ten tweede, met behulp van een confocale fluorescentiemicroscoop, ze zagen hoeveel van de bacteriën waren gestorven of nog leefden. Voor de bacteriën die in leven bleven, ze zagen dat de biofilmbacteriën planktoncellen werden, het herstellen van hun gevoeligheid of zwakte voor antibiotische therapie en voor de reactie van het immuunsysteem. Voor de dode bacteriën, ze merkten op dat bij het vergroten van de hoeveelheid licht die aan het oppervlak van het gaas werd afgegeven, de bacteriën zouden hun hechting verliezen en van het oppervlak afpellen. Ten derde, ze bevestigden dat werken op nabij-infraroodlichtbereiken volledig compatibel was met in-vivo-instellingen, wat betekent dat een dergelijke techniek hoogstwaarschijnlijk het omliggende gezonde weefsel niet zou beschadigen. Eindelijk, ze herhaalden de behandeling en bevestigden dat de herhaalde verwarming van het gaas de omzettingsefficiëntie niet had beïnvloed.
Zoals ICREA Prof bij ICFO Romain Quidant opmerkt, "de resultaten van deze studie hebben de weg vrijgemaakt voor het gebruik van plasmon-nanotechnologieën om de vorming van bacteriële biofilm aan het oppervlak van chirurgische implantaten te voorkomen. Er zijn nog verschillende problemen die moeten worden aangepakt, maar het is belangrijk om te benadrukken dat een dergelijke techniek inderdaad betekenen een radicale verandering in operatieprocedures en verdere patiënt na herstel."
Dr. Pau Turon, Directeur Onderzoek en Ontwikkeling bij B. Braun Surgical, S.A. legt uit, "Onze inzet om beroepsbeoefenaren in de gezondheidszorg te helpen ziekenhuisgerelateerde infecties te voorkomen, zet ons ertoe aan nieuwe strategieën te ontwikkelen om bacteriën en biofilms te bestrijden. Bovendien, het onderzoeksteam onderzoekt om dergelijke technologie uit te breiden naar andere sectoren waar biofilms moeten worden vermeden."
 Wetenschappers ontwikkelen nieuwe aanpak om te voorspellen hoe vloeistoffen bevriezen
Wetenschappers ontwikkelen nieuwe aanpak om te voorspellen hoe vloeistoffen bevriezen Cool touch-shirts kunnen ervoor zorgen dat je je koel voelt op warme dagen, maar welke materialen werken het beste?
Cool touch-shirts kunnen ervoor zorgen dat je je koel voelt op warme dagen, maar welke materialen werken het beste? Leerachtige materialen maken van schimmels
Leerachtige materialen maken van schimmels Hoe atomen in chemische formules te tellen
Hoe atomen in chemische formules te tellen Stapsgewijze hydrideoverdracht in de biosynthese van chlorofyl
Stapsgewijze hydrideoverdracht in de biosynthese van chlorofyl
Hoofdlijnen
- De Atlantische steuren verblijven
- Wetenschappers werken samen aan onderzoek om bedreigde Afrikaanse pinguïns te redden
- Een 3D-model plantencel maken zonder voedsel
- De verschillen tussen Mendelian & Polygenic Traits
- Een beetje stress is goed voor de gezondheid van de cellen en een lang leven
- Zien in het donker - hoe plantenwortels water waarnemen door middel van groei
- Zelfbevruchtende vissen hebben een verrassende hoeveelheid genetische diversiteit
- Wat betekent inoculeren in de microbiologie?
- Grote bedreigingen voor bodemecosystemen door een combinatie van invasieve soorten en klimaatverandering
- Technieken voor de manipulatie van materie op nanoschaal:nieuwe inzichten over 3D-printen

- Elektronische schakelingen geprint met een resolutie van één micron
- Oriëntatiepunt-experiment op golfinterferentie uit het begin van de 19e eeuw wordt opnieuw bekeken met behulp van gouden nanodeeltjes
- Nanotech-systeem, cellulaire verwarming kan de behandeling van eierstokkanker verbeteren
- Vijf manieren waarop natuurlijke nanotechnologie menselijk ontwerp kan inspireren

 Gegevens over record permafrost op lange termijn Arctische dooi
Gegevens over record permafrost op lange termijn Arctische dooi Een zelfwissende chip voor beveiliging en anti-namaaktechnologie
Een zelfwissende chip voor beveiliging en anti-namaaktechnologie Hongaarse wetenschappers gealarmeerd door geplande overname door de overheid
Hongaarse wetenschappers gealarmeerd door geplande overname door de overheid Verschillende manieren om de pH van drinkwater te verhogen
Verschillende manieren om de pH van drinkwater te verhogen Onderzoekers ontdekken eerste enzymen die een klassieke organische reactie katalyseren
Onderzoekers ontdekken eerste enzymen die een klassieke organische reactie katalyseren 1,5 miljard gevoelige documenten op open internet:onderzoekers
1,5 miljard gevoelige documenten op open internet:onderzoekers Voorwaarden voor stervorming begrijpen
Voorwaarden voor stervorming begrijpen Ouderen gebruiken sociale media om minder persoonlijke interacties te compenseren, studie zegt:
Ouderen gebruiken sociale media om minder persoonlijke interacties te compenseren, studie zegt:
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

