
Wetenschap
Onderzoekers ontdekken eerste enzymen die een klassieke organische reactie katalyseren
Krediet:Universiteit van Californië, Los Angeles
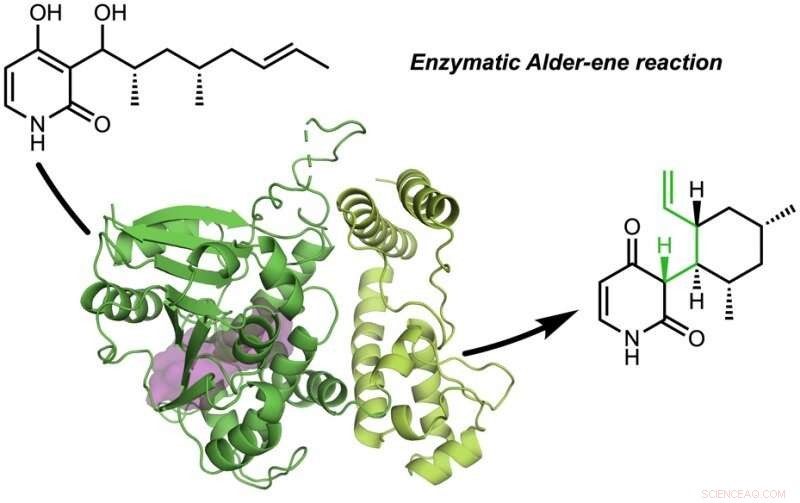
de Tang, Garg, en Houk-onderzoeksgroepen hebben de natuurlijke eiwitkatalysatoren (enzymen) van de natuur ontdekt die de Alder-een-reactie katalyseren.
Alle groepen maken deel uit van de UCLA-afdeling Chemie en Biochemie. Professor Yi Tang is de Chancellor Professor aan de UCLA Department of Chemical and Biomolecular Engineering en heeft ook een gezamenlijke aanstelling in de Department of Bioengineering. Professor Ken Houk bekleedt de Saul Winstein Distinguished Research Chair in Organic Chemistry en Professor Neil Garg bekleedt de Kenneth N. Trueblood Endowed Chair in Chemistry &Biochemistry en is de afdelingsvoorzitter.
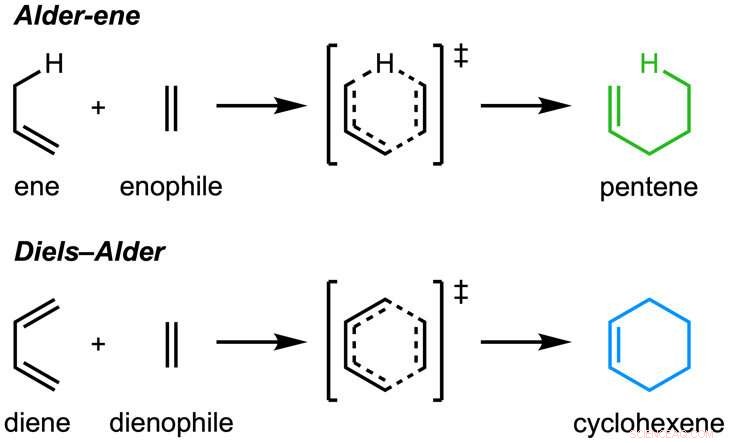
De krant, "Een enzymatische Alder-een-reactie" werd gepubliceerd in Natuur . De Alder-ene-reactie werd ontdekt in 1943, maar is tot nu toe alleen gebruikt voor chemische synthese in het laboratorium. De Alder-een-reactie is een voorbeeld van een pericyclische reactie en een analoog van de algemeen bekende Diels-Alder-reactie. Eerder, Tang en Houk identificeerden een nieuwe klasse enzymen - de pericyclasen - vanwege hun vermogen om pericyclische reacties in het primaire en secundaire metabolisme te versnellen.
In samenwerking met Jiahai Zhou van het Shanghai Institute of Organic Chemistry, de Tang-Garg-Houk-groepen rapporteerden de structuren en mechanismen van twee groepen enzymen die een stereoselectieve dehydratie en gelijktijdige pericyclische reactie katalyseren, hieronder weergegeven, waarbij de kleine symbolen zoals PdxI natuurlijke enzymen (eiwitkatalysatoren) aangeven die door de Tang-groep zijn ontdekt. Eén groep enzymen katalyseert een Alder-een-reactie, en de tweede katalyseert hetero-Diels-Alder-reacties.
-
Krediet:Universiteit van Californië, Los Angeles
-

Krediet:Universiteit van Californië, Los Angeles
Het artikel beschrijft de uiteenlopende synthese van pyridoxatine en asperpyridon A. Uitgaande van het alcoholsubstraat, de enzymen vergemakkelijken een dehydratatie om een reactief chinonmethide-tussenproduct te vormen waaruit de pyridoxatine- en asperpyridon A-skeletten kunnen worden gevormd door Alder-een- of Diels-Alder-reactie. Masao Ohashi in de Tang-groep, en Cooper Jamieson in de Houk- en Tang-groepen werkten samen om de factoren in de enzymen te identificeren die bepalen welke reactie plaatsvindt. Computationele voorspellingen leidden experimentele modificaties die de enzymen veranderden om de andere reactie te katalyseren. Dit type eiwittechnologie belooft in de toekomst de laboratoriumsynthese van verwante natuurlijke producten te beïnvloeden.
Krediet:Universiteit van Californië, Los Angeles
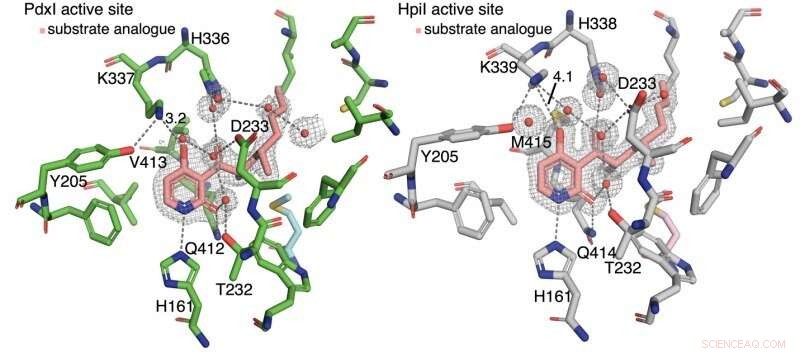
De auteurs ontdekten dat waterstofbinding aan het pyridon C4 het reactietype regelt. In enzymen PdxI, AdxI, en MdxI, een lysineresidu (K337) waterstofbindingen aan C4. Dit vermindert de nucleofiliciteit van de zuurstof en is ongunstig voor de hetero-Diels-Alder-reactie. PdxI, AdxI, en MdxI gebruiken deze strategie om selectief het pyridoxatineskelet te vormen. Enzymen EpiI, UpiI, en HpiI blokkeren het optreden van deze waterstofbinding met een flexibel methionineresidu (M415) en vergemakkelijken daardoor de vorming van het asperpyridon A-skelet. Dit subtiele geometrische verschil in de actieve plaatsen zorgt voor een vrij grote elektronische verandering in het substraat en regelt de enzymatische pericyclische reactie.
Hoofdlijnen
- Wat zijn de primaire functies van fosfolipiden?
- Wanneer treedt melkzuurfermentatie op?
- Woordproblemen schrijven voor Math
- Onderzoekers richten zich op invasieve, verderfelijke gevlekte lantaarnvlieg
- Gestresste stokstaartjes helpen minder snel groep
- Onderzoekers ontwikkelen krachtige nieuwe methode voor microbioomanalyse
- Hoe bacteriën met zout te doden
- Hoe een eenvoudige microscoop te maken
- Wat is een kruisverwijzingssysteem?
- Snelle test om astma te diagnosticeren

- Gemengde valentietoestanden in loodperovskieten
- Een nieuwe strategie om 2-D anorganische materialen te synthetiseren die in condensatoren worden gebruikt, batterijen, en composieten
- Nikkelferriet bevordert de capaciteit en cyclusstabiliteit van lithium-zwavelbatterijen
- Nieuwe strategie om katalysatoren met één atoom te fabriceren via elektrochemische depositie

 THz-emissiespectroscopie onthult optische respons van GaInN/GaN meerdere kwantumputten
THz-emissiespectroscopie onthult optische respons van GaInN/GaN meerdere kwantumputten Pulsen van zinkende koolstof die de diepzee bereiken, worden niet vastgelegd in wereldwijde klimaatmodellen
Pulsen van zinkende koolstof die de diepzee bereiken, worden niet vastgelegd in wereldwijde klimaatmodellen Japans ANA streeft naar koolstofneutraliteit in 2050
Japans ANA streeft naar koolstofneutraliteit in 2050 Is Chicago de meest winderige stad in de VS?
Is Chicago de meest winderige stad in de VS?  Waarom is kopersulfaat blauw?
Waarom is kopersulfaat blauw?  Een virtual reality-camera legt het leven en de wetenschap aan boord van het ruimtestation vast
Een virtual reality-camera legt het leven en de wetenschap aan boord van het ruimtestation vast Algen-bosbouw, bio-energiemix kan helpen om CO2 uit de lucht te laten verdwijnen
Algen-bosbouw, bio-energiemix kan helpen om CO2 uit de lucht te laten verdwijnen Zonnecellen van de volgende generatie presteren beter als er een camera in de buurt is
Zonnecellen van de volgende generatie presteren beter als er een camera in de buurt is
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com


