
Wetenschap
Minimalistische biostructuren ontworpen om nanomaterialen te maken
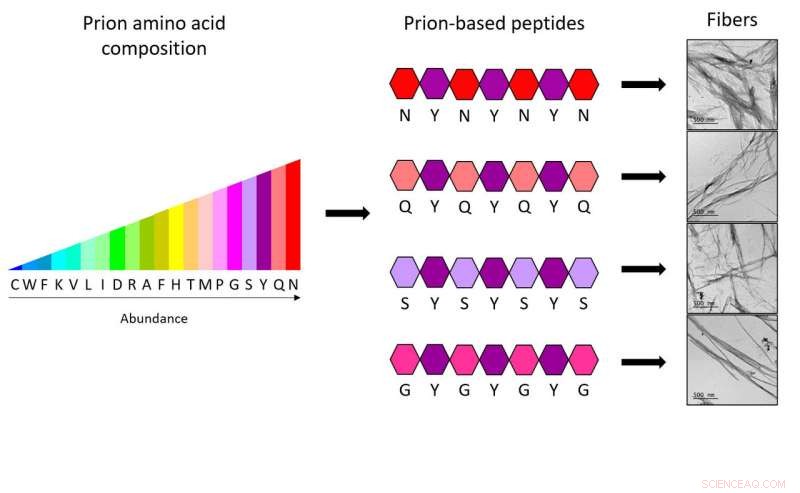
Met de nieuwe heptapeptiden, onderzoekers van de IBB-UAB tonen aan dat slechts vier verschillende soorten aminozuren, op een specifieke manier verdeeld en altijd gecombineerd met een ander vijfde type, zijn voldoende om de volledige code te verkrijgen die nodig is om synthetische prionvezels te vormen. Krediet:IBB-UAB
Onderzoekers van het Institute of Biotechnology and Biomedicine (IBB-UAB) hebben vier peptiden gegenereerd, moleculen kleiner dan eiwitten, in staat om op een gecontroleerde manier zelf te assembleren om nanomaterialen te vormen. Het onderzoek, gepubliceerd in het tijdschrift ACS Nano , werd uitgevoerd door Salvador Ventura, Marta Díaz Caballero en Susanna Navarro (IBB-UAB), en omvatte de samenwerking van Isabel Fuentes en Francesc Teixidor (Institute of Materials Science van Barcelona, ICMAB-CSIC).
De nieuwe moleculen worden gevormd door een keten van zeven aminozuren, die elk uit slechts twee aminozuren bestaan, waardoor de kosten voor het creëren van functionele synthetische amyloïdestructuren waarmee nanomaterialen voor biogeneeskunde en nanotechnologie kunnen worden gegenereerd, aanzienlijk worden versneld en verlaagd.
In de biotechnologie, het genereren van functionele synthetische amyloïde structuren om nanostructuren te vormen door het natuurlijke generatieproces te imiteren is niet nieuw. De assemblage van eiwitten tot stabiele vezels maakt het mogelijk om supramoleculaire vormen te creëren die geen geïsoleerd eiwit kan creëren, en die worden gebruikt als nanogeleiders, fotovoltaïsche constructies, biosensoren en katalysatoren.
Best recent, onderzoekers begonnen met het synthetiseren van prioneiwitsequenties om nanomaterialen te vormen. De interesse in deze sequenties ligt in het feit dat de eiwitten op een langzamere en meer gecontroleerde manier assembleren, vormen zeer geordend, niet-toxische nanostructuren. Echter, het feit dat de reeks zo lang is, met meer dan 150 aminozuren, maakt het erg moeilijk en duur om te synthetiseren.
"We hebben aangetoond dat een adequaat ontwerp het mogelijk kan maken om de grootte van synthetische prionsequenties te verminderen tot slechts 7 aminozuren, met behoud van dezelfde eigenschappen. De vier peptiden die we hebben gefabriceerd, zijn de kortste structuren van dit type die tot nu toe zijn gemaakt, en zijn in staat om stabiele fibrilassemblages te vormen, " zegt Salvador Ventura, onderzoeker aan de IBB en de UAB afdeling Biochemie en Moleculaire Biologie.
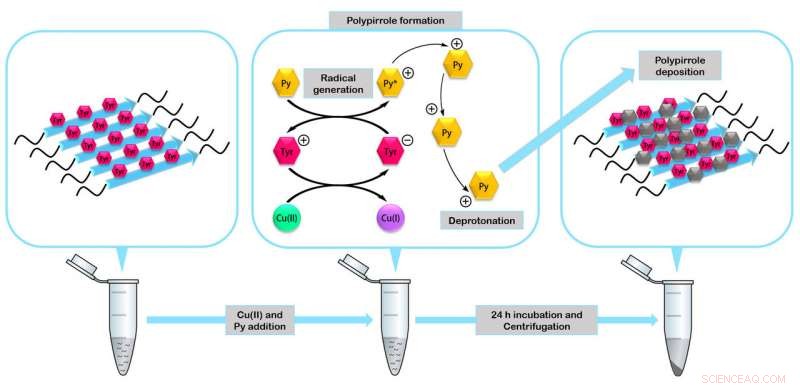
De peptiden assembleren om miniatuur-enzymen te vormen die als katalysatoren kunnen werken bij de vorming van nanomaterialen zoals het geleidende polymeer polypyrrool. Krediet:IBB-UAB
In de studie, de onderzoekers verifieerden de stabiliteit en functionaliteit van de vier gefabriceerde peptiden. Ze bouwden een van de meest degradatiebestendige biologische nanomaterialen die tot nu toe zijn beschreven, nanokabels bedekt met zilver die kunnen werken als elektrische nanogeleiders en fibrillaire mini-enzymen die kunnen werken als katalysatoren bij de vorming van organische nanomaterialen.
De nieuwe moleculen hebben tal van toepassingen, maar de onderzoekers richten zich op "het genereren van elektrische nanogeleiders en maken gebruik van de kennis van de amyloïdestructuur om synthetische vezels te genereren die katalysatoren kunnen zijn voor nieuwe chemische reacties. Het uiteindelijke doel zal zijn om hybride peptide-anorganische materialen te genereren die in staat zijn om complexe reacties maken, zoals die gecreëerd door de fotosystemen van planten, " merkt de IBB-onderzoeker op.
prion domeinen, in het hart van de zaak
Om nieuwe peptiden te genereren, IBB-onderzoekers baseerden hun werk op specifieke sequenties van prioneiwitten, bekend als priondomeinen (PrDs). "We hebben onderzocht welke aminozuren vaker voorkomen en hoe ze in deze regio's worden verspreid, wat aantoont dat slechts 4 verschillende soorten aminozuren die op een specifieke manier zijn verdeeld en altijd gecombineerd door een vijfde type aminozuur voldoende zijn om de volledige code te hebben die nodig is om synthetische prionvezels te vormen. In feite, elk van de ontworpen heptapeptiden (mini-PrD's) bevat slechts twee verschillende soorten aminozuren, ", zegt Salvador Ventura.
De studie demonstreert het vermogen van mini-PrD's om zeer geordende nanostructuren te maken, een proces waarvan men dacht dat het onmogelijk was gezien de grote aanwezigheid van polaire aminozuren. De resulterende peptiden zijn meer polair dan enig ander peptide van vergelijkbare grootte dat tot nu toe werd gebruikt om synthetische amyloïden te vormen; dit, bijvoorbeeld, stelt hen in staat om in dezelfde omstandigheden te functioneren als natuurlijke enzymen.
Deze studie heeft onderzoekers van de IBB Protein Folding and Conformational Diseases-groep geholpen, geregisseerd door Dr. Ventura, om een nieuwe onderzoekslijn te openen gericht op het ontwerp van nanomaterialen.
"We hebben nooit aan nanotechnologie gewerkt, maar tegelijkertijd hebben we het altijd dichtbij gehad, omdat onze kracht ligt in de kennis van het moleculaire mechanisme van eiwitassemblage in amyloïde structuren. We werken al lange tijd aan het creëren van strategieën om dit fenomeen bij neurodegeneratieve ziekten te voorkomen. Deze kennis heeft ons in staat gesteld om nieuwe moleculen te ontwerpen die we nu voorstellen voor de fabricage van nieuwe nanomaterialen, " Dr. Ventura concludeert.
 Onderzoekers melden doorbraak in 3D-geprint latexrubber
Onderzoekers melden doorbraak in 3D-geprint latexrubber Kunstmatige cellen reageren op veranderingen in de omgeving
Kunstmatige cellen reageren op veranderingen in de omgeving Kooldioxide-naar-methanolproces verbeterd door katalysator
Kooldioxide-naar-methanolproces verbeterd door katalysator Niet-toxische onderwaterlijm kan nieuwe chirurgische lijm opleveren
Niet-toxische onderwaterlijm kan nieuwe chirurgische lijm opleveren Platform met hoge doorvoer maakt het in kaart brengen van activiteiten van opkomende kankergeneesmiddelen mogelijk
Platform met hoge doorvoer maakt het in kaart brengen van activiteiten van opkomende kankergeneesmiddelen mogelijk
 Waarom conflicten in Afrika de schuld geven van klimaatverandering is misplaatst
Waarom conflicten in Afrika de schuld geven van klimaatverandering is misplaatst Arseenademend leven ontdekt in de tropische Stille Oceaan
Arseenademend leven ontdekt in de tropische Stille Oceaan Hoe zijn planten aangepast aan het koraalrif om te overleven?
Hoe zijn planten aangepast aan het koraalrif om te overleven?  China's meest smoggste stad sluit scholen te midden van publieke woede
China's meest smoggste stad sluit scholen te midden van publieke woede Meren geïsoleerd onder Antarctisch ijs kunnen vatbaarder zijn voor leven dan gedacht
Meren geïsoleerd onder Antarctisch ijs kunnen vatbaarder zijn voor leven dan gedacht
Hoofdlijnen
- Cat Chromosome-informatie
- Levenslange bloedproductie is afhankelijk van honderden cellen die zich vóór de geboorte vormen
- Wat is het belang van nucleïnezuren?
- Celademhalingsexperimenten
- Anatomie en fysiologie van een synapsenstructuur
- Zijn gelukkige mensen aardiger?
- De morfologie van algen
- Interspecifieke concurrentie versus intraspecifieke concurrentie
- Nieuwe screeningstechniek stelt veredelaars in staat sneller droogteresistente rassen te ontwikkelen
- Individuele atomen observeren in 3D-nanomaterialen en hun oppervlakken
- Chemisch op maat gemaakte grafeen

- Spincasting is veelbelovend voor het maken van dunne films van nanodeeltjes

- Verdwijnende koolstofcircuits op grafeen kunnen veiligheid bieden, biomedische toepassingen
- Catch-22 in op grafeen gebaseerde moleculaire apparaten opgelost

 Een microlens-gebeurtenis gezien vanuit drie posities in de ruimte
Een microlens-gebeurtenis gezien vanuit drie posities in de ruimte Scythische mensen waren niet alleen nomadische krijgers, maar soms tot rust gekomen
Scythische mensen waren niet alleen nomadische krijgers, maar soms tot rust gekomen Facebook-berichtenapp voegt realtime vertalingen toe
Facebook-berichtenapp voegt realtime vertalingen toe Hoe lockdown ons seksleven veranderde, volgens nieuw onderzoek
Hoe lockdown ons seksleven veranderde, volgens nieuw onderzoek Ideeën voor schoolprojecten op insecten
Ideeën voor schoolprojecten op insecten Explainer:wat is onderzoekend leren en hoe helpt het kinderen voor te bereiden op de echte wereld?
Explainer:wat is onderzoekend leren en hoe helpt het kinderen voor te bereiden op de echte wereld? Fysieke aanpassingen van rondwormen
Fysieke aanpassingen van rondwormen NASA vraagt om instrumenten, technologieën voor levering aan de maan
NASA vraagt om instrumenten, technologieën voor levering aan de maan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

