
Wetenschap
Kankerbestrijdende nanorobots die zijn geprogrammeerd om tumoren te zoeken en te vernietigen
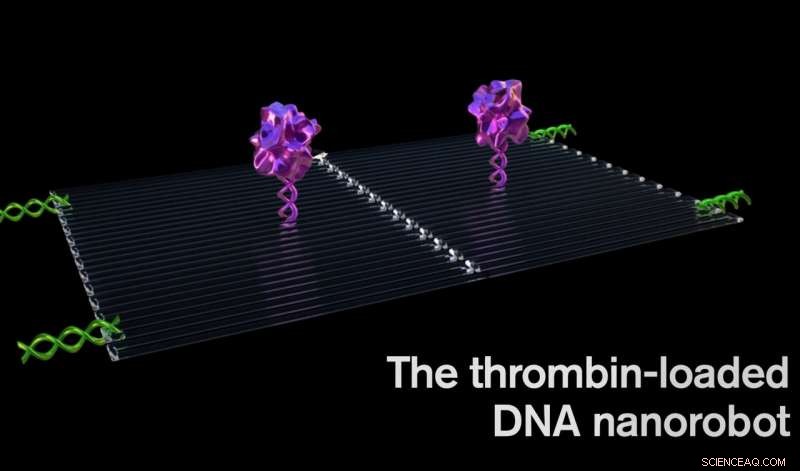
Trombine kan de doorbloeding van de tumor blokkeren door het bloed te stollen in de bloedvaten die de tumorgroei voeden, een soort tumor mini-hartaanval veroorzaken, en leidend tot de dood van tumorweefsel. Krediet:Jason Drees, Staatsuniversiteit van Arizona
In een belangrijke vooruitgang in de nanogeneeskunde, Wetenschappers van de Arizona State University (ASU), in samenwerking met onderzoekers van het National Center for Nanoscience and Technology (NCNST), van de Chinese Academie van Wetenschappen, hebben met succes nanorobots geprogrammeerd om tumoren te verkleinen door hun bloedtoevoer af te sluiten.
"We hebben de eerste volledig autonome, DNA-robotsysteem voor een zeer nauwkeurig medicijnontwerp en gerichte kankertherapie, " zei Hao Yan, directeur van het ASU Biodesign Institute's Centre for Molecular Design and Biomimetics en de Milton Glick Professor in de School of Molecular Sciences.
"Bovendien, deze technologie is een strategie die voor veel soorten kanker kan worden gebruikt, aangezien alle solide tumorvoedende bloedvaten in wezen hetzelfde zijn, " zei Jan.
De succesvolle demonstratie van de technologie, de eerste studie in zijn soort bij zoogdieren die borstkanker gebruiken, melanoma, muismodellen voor eierstok- en longkanker, werd gepubliceerd in het tijdschrift Natuur Biotechnologie .
Zoeken en vernietigen
Yan is een expert op het gebied van DNA-origami, die in de afgelopen twee decennia heeft fabricage op atomaire schaal ontwikkeld om steeds complexere structuren te bouwen.
De stenen om hun structuren te bouwen zijn afkomstig van DNA, die zichzelf in allerlei vormen en maten kan vouwen - allemaal op een schaal die duizend keer kleiner is dan de breedte van een mensenhaar - in de hoop op een dag een revolutie teweeg te brengen in computergebruik, elektronica en medicijnen.
Die ene dag komt misschien iets sneller dan verwacht.
Nanogeneeskunde is een nieuwe tak van geneeskunde die de belofte van nanotechnologie wil combineren om geheel nieuwe wegen te openen voor behandelingen, zoals het maken van minuscule, nanodeeltjes ter grootte van een molecuul om moeilijke ziekten te diagnosticeren en te behandelen, vooral kanker.
Tot nu, de uitdaging om nanogeneeskunde te bevorderen was moeilijk omdat wetenschappers wilden ontwerpen, nanorobots bouwen en zorgvuldig controleren om actief kankergezwellen te zoeken en te vernietigen - zonder daarbij gezonde cellen te schaden.
Het internationale team van onderzoekers overwon dit probleem door een schijnbaar eenvoudige strategie te gebruiken om zeer selectief een tumor te zoeken en uit te hongeren.
Dit werk is ongeveer 5 jaar geleden gestart. De NCNST-onderzoekers wilden eerst specifiek de bloedtoevoer naar tumoren afsnijden door bloedstolling te induceren met hoge therapeutische werkzaamheid en veiligheidsprofielen in meerdere solide tumoren met behulp van op DNA gebaseerde nanodragers. De expertise van prof. Hao Yan heeft het ontwerp van de nanogeneeskunde geüpgraded tot een volledig programmeerbaar robotsysteem, in staat zijn missie geheel zelfstandig uit te voeren.
"Deze nanorobots kunnen worden geprogrammeerd om moleculaire ladingen te transporteren en ter plaatse blokkades van de bloedtoevoer naar tumoren te veroorzaken, wat kan leiden tot weefselsterfte en de tumor doet krimpen, " zei Baoquan Ding, een professor aan het NCNST, gevestigd in Peking, China.
Nanorobots te hulp
Om hun studie uit te voeren, de wetenschappers maakten gebruik van een bekend muistumormodel, waar menselijke kankercellen in een muis worden geïnjecteerd om agressieve tumorgroei te induceren.
Toen de tumor eenmaal aan het groeien was, de nanorobots werden ingezet om te hulp te schieten.
Elke nanorobot is gemaakt van een platte, rechthoekig DNA-origamiblad, 90 nanometer bij 60 nanometer groot. Een belangrijk bloedstollingsenzym, trombine genoemd, aan het oppervlak is bevestigd.
Trombine kan de doorbloeding van de tumor blokkeren door het bloed te stollen in de bloedvaten die de tumorgroei voeden, een soort tumor mini-hartaanval veroorzaken, en leidend tot de dood van tumorweefsel.
Eerst, een gemiddelde van vier trombinemoleculen werd bevestigd aan een platte DNA-steiger. Volgende, het platte vel werd op zichzelf gevouwen als een vel papier tot een cirkel om een holle buis te maken.
Ze werden met een infuus in een muis geïnjecteerd, reisde vervolgens door de bloedbaan, homing in op de tumoren.
De sleutel tot het programmeren van een nanorobot die alleen een kankercel aanvalt, was om een speciale lading op het oppervlak te plaatsen, een DNA-aptameer genoemd. Het DNA-aptameer kan specifiek gericht zijn op een eiwit, genaamd nucleoline, dat wordt alleen in grote hoeveelheden gemaakt op het oppervlak van tumorendotheelcellen - en wordt niet gevonden op het oppervlak van gezonde cellen.
Eenmaal gebonden aan het oppervlak van het tumorbloedvat, de nanorobot was geprogrammeerd, zoals het beruchte paard van Troje, om zijn nietsvermoedende medicijnlading in het hart van de tumor af te leveren, het blootstellen van een enzym dat trombine wordt genoemd en dat essentieel is voor de bloedstolling.
De nanorobots werkten snel, zich in grote aantallen verzamelen om de tumor slechts enkele uren na injectie snel te omringen.
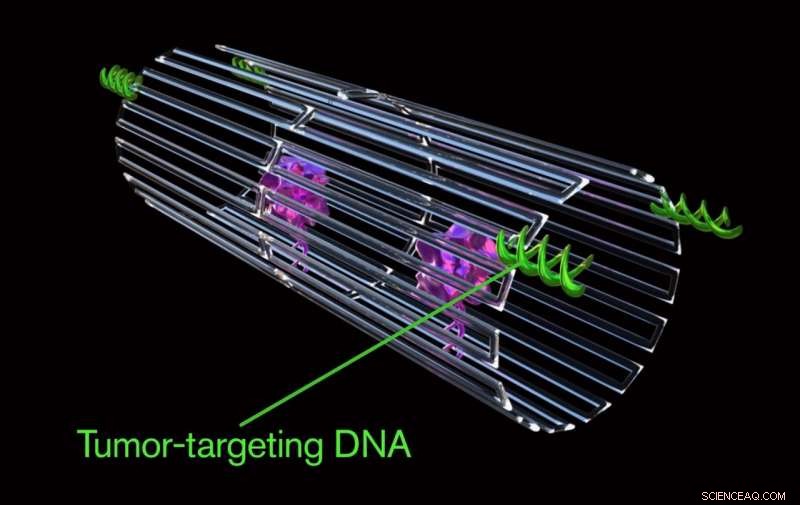
De sleutel tot het programmeren van een nanorobot die alleen een kankercel aanvalt, was om een speciale lading op het oppervlak te plaatsen, een DNA-aptameer genoemd. Het DNA-aptameer kan zich specifiek richten op een eiwit, genaamd nucleoline, dat wordt alleen in grote hoeveelheden gemaakt op het oppervlak van tumorendotheelcellen - en wordt niet gevonden op het oppervlak van gezonde cellen. Krediet:Jason Drees, Staatsuniversiteit van Arizona
Veilig en degelijk ontwerp
Eerst en vooral, het team toonde aan dat de nanorobots veilig en effectief waren in het verkleinen van tumoren.
"De nanorobot bleek veilig en immunologisch inert te zijn voor gebruik in normale muizen en, ook in Bama miniatuurvarkens, zonder waarneembare veranderingen in normale bloedstolling of celmorfologie, " zei Yuliang Zhao, ook een professor aan NCNST en hoofdwetenschapper van het internationale samenwerkingsteam.
Het belangrijkste is, er was geen bewijs dat de nanorobots zich naar de hersenen verspreidden waar het ongewenste bijwerkingen kon veroorzaken, zoals een beroerte.
"De nanorobots zijn beslist veilig in de normale weefsels van muizen en grote dieren, " zei Guangjun Nie, een andere professor aan het NCNST en een belangrijk lid van het samenwerkingsteam.
De behandeling blokkeerde de bloedtoevoer naar de tumor en veroorzaakte binnen 24 uur schade aan het tumorweefsel, terwijl het geen effect had op gezonde weefsels. Na het aanvallen van tumoren, de meeste nanorobots werden na 24 uur uit het lichaam verwijderd en afgebroken.
Tegen twee dagen, er waren aanwijzingen voor vergevorderde trombose, en 3 dagen, trombi in alle tumorvaten werden waargenomen.
De sleutel is om trombine alleen te activeren als het zich in de bloedvaten van de tumor bevindt. Ook, in het melanoommuismodel, 3 van de 8 muizen die de nanorobottherapie kregen, vertoonden volledige regressie van de tumoren. De mediane overlevingstijd meer dan verdubbeld, verlengd van 20,5 tot 45 dagen.
Ze probeerden hun systeem ook uit in een test van een primair muis-longkankermodel, die het menselijke klinische beloop van longkankerpatiënten nabootst. Ze vertoonden krimp van tumorweefsel na een behandeling van 2 weken.
Wetenschap van het allerkleinste wordt groot
voor Jan, de belangrijke studiemijlpaal vertegenwoordigt het einde van het begin voor nanogeneeskunde.
"De trombine-afgifte-DNA-nanorobot vormt een belangrijke vooruitgang in de toepassing van DNA-nanotechnologie voor kankertherapie, " zei Yan. "In een melanoommuismodel, de nanorobot tastte niet alleen de primaire tumor aan, maar verhinderde ook de vorming van metastasen, met veelbelovend therapeutisch potentieel."
Yan en zijn medewerkers zijn nu actief op zoek naar klinische partners om deze technologie verder te ontwikkelen.
"Ik denk dat we veel dichter bij de werkelijkheid staan, praktische medische toepassingen van de technologie, " zei Yan. "Combinaties van verschillende rationeel ontworpen nanorobots die verschillende middelen dragen, kunnen helpen om het uiteindelijke doel van kankeronderzoek te bereiken:de uitroeiing van solide tumoren en gevasculariseerde metastasen. Verder, de huidige strategie kan worden ontwikkeld als een platform voor medicijnafgifte voor de behandeling van andere ziekten door wijziging van de geometrie van de nanostructuren, de doelgroepen en de geladen ladingen."
 Diffusion Lab Experiments
Diffusion Lab Experiments Actieve vloeibare kristalsystemen onderzocht op zoek naar autonome materiaalsystemen
Actieve vloeibare kristalsystemen onderzocht op zoek naar autonome materiaalsystemen Voor een echte oorlog tegen afval, de mode-industrie moet meer uitgeven aan onderzoek
Voor een echte oorlog tegen afval, de mode-industrie moet meer uitgeven aan onderzoek Hoe de molaire hitte van neutralisatie te berekenen
Hoe de molaire hitte van neutralisatie te berekenen Aanvankelijke afstoting bij chemische binding sluit latere aantrekking niet uit
Aanvankelijke afstoting bij chemische binding sluit latere aantrekking niet uit
Hoofdlijnen
- We kregen te maken met misbruik omdat we mensen vroegen om wespen te doden voor de wetenschap - hier is waarom het de moeite waard was
- De rol van enzymen bij cellulaire ademhaling
- Het verschil tussen histon en nonhiston
- EU stemt ermee in om in 2018 meer vis op een duurzame manier te vangen
- Maak kennis met de oudste dierlijke afstamming van Madagascar, een draaimolenkever met een 206 miljoen jaar oude oorsprong
- 10 wonderkinderen
- Making Better Humans - Het huwelijk van mens en machine
- Menselijk genoom DNA-sequentietypen
- Voorbeelden van genetische diversiteit
- Ontdekking dat grootte belangrijk is in cel-tot-cel communicatie, zou nieuwe methoden voor ziektediagnose en -behandeling kunnen ontsluiten
- Koolstofnanobuisjes gekweekt in verbrandingsvlammen

- Team gebruikt nanotechnologie om elektronen te koelen zonder externe bronnen

- Nieuw materiaal maakt ultradunne zonnecellen mogelijk

- Grafeen quantum dots:The next big small thing

 Hoe om te gaan met extreme hittedagen zonder de rekeningen van de airconditioning te verhogen
Hoe om te gaan met extreme hittedagen zonder de rekeningen van de airconditioning te verhogen Magnitude 6.3 aardbeving treft de Salomonseilanden
Magnitude 6.3 aardbeving treft de Salomonseilanden Hoe de V-22 Visarend werkt
Hoe de V-22 Visarend werkt  Gratis tool voorspelt of de volgende stortbui je kelder zal overstromen
Gratis tool voorspelt of de volgende stortbui je kelder zal overstromen Nieuwe ultra-geminiaturiseerde scope minder invasief, produceert afbeeldingen van hogere kwaliteit
Nieuwe ultra-geminiaturiseerde scope minder invasief, produceert afbeeldingen van hogere kwaliteit Bacteriemonsters die een eeuw geleden op Antarctica zijn verzameld, bijna identiek aan hedendaagse monsters
Bacteriemonsters die een eeuw geleden op Antarctica zijn verzameld, bijna identiek aan hedendaagse monsters Kunstmatig van kleur veranderend materiaal dat de huid van een kameleon nabootst, kan de versheid van zeevruchten detecteren
Kunstmatig van kleur veranderend materiaal dat de huid van een kameleon nabootst, kan de versheid van zeevruchten detecteren Verbeterd patent voor raketmotor met vloeibare zuurstof-propyleen weerspiegelt de visie van het bedrijf in baanpogingen
Verbeterd patent voor raketmotor met vloeibare zuurstof-propyleen weerspiegelt de visie van het bedrijf in baanpogingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

