Wetenschap
Shigella-bacterie maakt gebruik van een fysieke kracht genaamd endocytose in het celmembraan
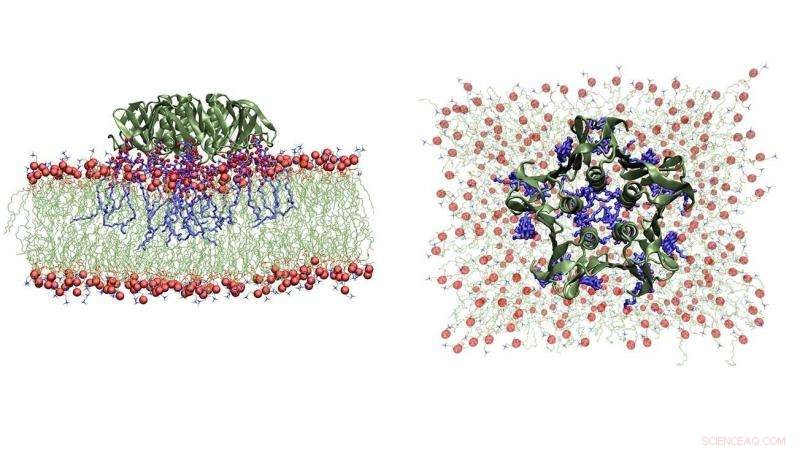
Snapshots van een Molecular Dynamics-simulatie van een enkel shigella-toxinedeeltje dat bindt aan zijn lipidepartners in het blaasjemembraan (zij- en bovenaanzicht). Krediet:Julian Shillcock/EPFL
De bacteriën die de shigella-darmziekte veroorzaken, gebruiken een toxine dat gebruikmaakt van een fysieke kracht in het celmembraan. Hoewel moeilijk te blokkeren, het is mogelijk om te vechten met nanodeeltjes die dezelfde kracht gebruiken.
Een enorm aantal ziekten is het gevolg van bacteriële en virusinfecties. Deze ziekteverwekkers komen via verschillende routes in de cellen van het lichaam terecht. Een nieuwe studie, gezamenlijk geleid door EPFL, meldt nu de ontdekking van een voorheen onbekende infectieroute die wordt gebruikt door de bacteriën die de shigellose veroorzaken, een intestinale infectieziekte die wordt gekenmerkt door bloederige diarree. In het nieuw ontdekte mechanisme, de Shigella-bacterie maakt gebruik van een generieke kracht die wordt gecreëerd door de fluctuaties van het eigen plasmamembraan van de cel. Het werk is gepubliceerd in ACS Nano .
De studie werd uitgevoerd door John Ipsen aan de Universiteit van Zuid-Denemarken, Ludger Johannes aan het Institut Curie in Frankrijk en Julian Shillcock aan EPFL.
Normaal gesproken, cellen reguleren de binnenkomst van vreemd materiaal zeer strak, om invasies van ziekteverwekkers zoals bacteriën en virussen te voorkomen. Als resultaat, de indringers hebben verschillende mechanismen ontwikkeld om de barrières te overwinnen en toegang te krijgen tot cellen.
Bijvoorbeeld, één route omvat het kapen van de eigen machinerie van de cel en het misleiden om het virus of de bacterie te internaliseren in een blaasje dat de cel zelf maakt. Dit proces, wat een van de normale manieren is waarop cellen grote moleculen opnemen, wordt "endocytose" genoemd.
De wetenschappers gebruikten verschillende blaasjessystemen en computersimulaties om een bacterieel invasiemechanisme te bestuderen dat enkele unieke eigenschappen lijkt te hebben. Het mechanisme wordt gebruikt, onder andere, door de bacteriën die shigella veroorzaken en die een kleine, rigide eiwit genaamd Shiga-toxine.
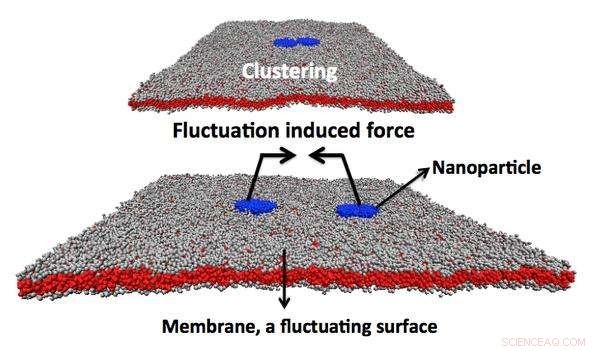
Illustratie van een simulatie van dissipatieve deeltjesdynamica die twee nauw gebonden toxines laat zien die aan elkaar zijn gebonden door de Casimir-achtige kracht. Krediet:Julian Shillcock/EPFL
Uit de studie bleek dat Shiga-toxinedeeltjes stevig binden aan bepaalde lipiden, of vetten, op het membraanoppervlak van de cel die moet worden binnengedrongen. Ze beginnen dan clusters te vormen op het membraan, waardoor het membraan naar binnen buigt, het creëren van buisvormige invaginaties, waardoor de toxinedeeltjes de cel binnenkomen. Eenmaal binnen, de Shiga-toxines wijzigen het genetische mechanisme van de cel, en de infectie is begonnen.
Maar de belangrijkste ontdekking was dat het toxine daadwerkelijk een generiek, fysieke kracht in het celmembraan om de invaginaties te produceren. Dit wordt de "Casimir-kracht" genoemd en werd voor het eerst beschreven als een theoretische kracht die werkt tussen twee geladen, parallel, geleidende oppervlakken.
Op het gebied van biologie, de Casimir-kracht wordt verondersteld te werken tussen membraangebonden eiwitten in cellen, aanwezig op alle vloeibare biologische celmembranen en ontstaan alleen wanneer de ziekteverwekker stevig aan het membraanoppervlak bindt.
De onderzoekers stellen voor dat Shigella-bacteriën, en andere ziekteverwekkers, zijn geëvolueerd om te profiteren van de Casimir-kracht die voortkomt uit het fluctuerende plasmamembraan om cellen te infecteren. In aanvulling, omdat de vetten waaraan het toxine bindt door de cel worden gebruikt voor zijn eigen activiteiten, het Shiga-toxine kan niet worden geblokkeerd om binnen te komen zonder de normale functies van de cel uit te schakelen of te wijzigen.
Nanodeeltjes voor medicijnafgifte
Maar omdat men denkt dat de Casimir-kracht ontstaat voor alle nauw gebonden nanodeeltjes op het oppervlak van het celmembraan, er is het potentieel voor het produceren van een roman, op nanodeeltjes gebaseerde route voor medicijnafgifte. Eerst, we zouden nanodeeltjes stevig aan het oppervlak van de cel moeten binden waar ze zullen clusteren. Tweede, de nanodeeltjes moeten ook de kromming van het celmembraan iets vergroten om de Casimir-kracht te benutten en toegang te krijgen tot de cel. Eenmaal binnen, ze kunnen beginnen met het maken van heilzaam, defensieve veranderingen in het gedrag van de cel.
"Waar de natuur heeft geleid tot het bedenken van een middel voor pathogenen om cellen te infecteren, gefabriceerde nanodeeltjes kunnen volgen om cellulaire disfunctie te behandelen, ', zegt Julian Shillcock.
 Typen elektroden die worden gebruikt bij het lassen
Typen elektroden die worden gebruikt bij het lassen  S-glutathionylering van door mensen induceerbaar Hsp70 onthult een regulerend mechanisme met betrekking tot het C-terminale α-helix deksel
S-glutathionylering van door mensen induceerbaar Hsp70 onthult een regulerend mechanisme met betrekking tot het C-terminale α-helix deksel Gestresste cacaobomen kunnen smaakvollere chocolade produceren
Gestresste cacaobomen kunnen smaakvollere chocolade produceren Randen en hoeken verhogen de efficiëntie van katalysatoren
Randen en hoeken verhogen de efficiëntie van katalysatoren Neutronen onthullen de wilde Weyl-wereld van halfmetalen
Neutronen onthullen de wilde Weyl-wereld van halfmetalen
 NASA-infraroodgegevens analyseren wolkentoptemperaturen in tropische cycloon Claudia
NASA-infraroodgegevens analyseren wolkentoptemperaturen in tropische cycloon Claudia Filippijnen schepen dumpen afval terug naar Canada
Filippijnen schepen dumpen afval terug naar Canada De gevaren van aluminiumfolie
De gevaren van aluminiumfolie  Hoe biobrandstoffen uit plantaardige vezels de opwarming van de aarde kunnen tegengaan
Hoe biobrandstoffen uit plantaardige vezels de opwarming van de aarde kunnen tegengaan Economische vlindervleugels kunnen een tornado voor klimaatactie veroorzaken
Economische vlindervleugels kunnen een tornado voor klimaatactie veroorzaken
Hoofdlijnen
- Ideeën voor het maken van een 3D-model van een cel
- Wat zijn Agar Slants?
- Wetenschappers vinden potentiële wapens voor de strijd tegen antibioticaresistentie
- Het verschil tussen craniologie en frenologie
Craniologie en frenologie zijn beide praktijken die de conformatie van de menselijke schedel onderzoeken; echter, de twee zijn heel verschillend. Craniologie is de studie van verschillen in vorm, groott
- Gespecialiseerde cellen in het lichaam
- Door het uitbreiden van het DNA-alfabet kunnen cellen nieuwe eiwitten produceren
- Nieuwe histonmodificaties koppelen metabolisme aan genactiviteit
- Het genoom van Leishmania onthult hoe deze parasiet zich aanpast aan veranderingen in de omgeving
- Onderzoek suggereert dat gevaarlijke gewassenschimmel giftige chemicaliën produceert om insecten af te weren
 Licht, fantastisch:de weg vooruit voor sneller, kleinere computerprocessors
Licht, fantastisch:de weg vooruit voor sneller, kleinere computerprocessors Hydrodynamische onderzoekers demonstreren objecten die in water zinken zonder weerstand
Hydrodynamische onderzoekers demonstreren objecten die in water zinken zonder weerstand Dingen Michael Faraday Uitgevonden
Dingen Michael Faraday Uitgevonden  Virtueel onderwijs legt digitale uitdagingen bloot voor zwarte gezinnen, studie vondsten
Virtueel onderwijs legt digitale uitdagingen bloot voor zwarte gezinnen, studie vondsten Celsius vs. Celsius
Celsius vs. Celsius  Dit is waarom we niet alleen op steden kunnen vertrouwen om klimaatverandering aan te pakken
Dit is waarom we niet alleen op steden kunnen vertrouwen om klimaatverandering aan te pakken Welke organismen eten zeewier?
Welke organismen eten zeewier?  Aanzienlijke vooruitgang bij het stabiliseren van perovskiet-zonnecellen
Aanzienlijke vooruitgang bij het stabiliseren van perovskiet-zonnecellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com