
Wetenschap
Wetenschappers ontdekken een nieuwe staat van materie voor water

Krediet:Shutterstock
Een van de meest elementaire dingen die we in de natuurwetenschappen op school leren, is dat water in drie verschillende toestanden kan bestaan, hetzij als vast ijs, vloeibaar water, of dampgas. Maar een internationaal team van wetenschappers heeft onlangs tekenen gevonden dat vloeibaar water in twee verschillende staten zou kunnen komen.
Schrijven in een experimenteel papier, gepubliceerd in de Internationaal tijdschrift voor nanotechnologie , de onderzoekers waren verrast toen ze ontdekten dat een aantal fysische eigenschappen van water hun gedrag veranderen tussen 50℃ en 60℃. Dit teken van een mogelijke verandering naar een tweede vloeibare toestand zou een verhitte discussie in de wetenschappelijke gemeenschap kunnen veroorzaken. En, indien bevestigd, het kan gevolgen hebben voor een reeks velden, inclusief nanotechnologie en biologie.
Staten van materie, ook wel "fasen" genoemd, zijn een sleutelbegrip in de studie van systemen gemaakt van atomen en moleculen. Grofweg gesproken, een systeem gevormd uit vele moleculen kan in een bepaald aantal configuraties worden gerangschikt, afhankelijk van de totale energie. Bij hogere temperaturen (en dus hogere energieën), de moleculen hebben meer mogelijke configuraties en zijn dus meer ongeorganiseerd en kunnen relatief vrij bewegen (de gasfase). Bij lagere temperaturen, de moleculen hebben een beperkter aantal configuraties en vormen zo een meer geordende fase (een vloeistof). Als de temperatuur verder daalt, ze rangschikken zich in een zeer specifieke configuratie, een vaste stof produceren.
Dit beeld is gebruikelijk voor relatief eenvoudige moleculen zoals koolstofdioxide of methaan, die drie duidelijke, verschillende toestanden (vloeibaar, vast en gas). Maar voor complexere moleculen, er is een groter aantal mogelijke configuraties en dit geeft aanleiding tot meer fasen. Een mooie illustratie hiervan is het rijke gedrag van vloeibare kristallen, die worden gevormd door complexe organische moleculen en kunnen stromen als vloeistoffen, maar hebben nog steeds een vaste kristallijne structuur
Omdat de fase van een stof wordt bepaald door hoe de moleculen zijn geconfigureerd, veel fysieke eigenschappen van die stof zullen abrupt veranderen als het van de ene toestand naar de andere gaat. In de recente krant de onderzoekers maten verschillende veelbetekenende fysieke eigenschappen van water bij temperaturen tussen 0 en 100 onder normale atmosferische omstandigheden (wat betekent dat het water een vloeistof was). Verrassend genoeg, ze vonden een knik in eigenschappen zoals de oppervlaktespanning van het water en de brekingsindex (een maat voor hoe licht er doorheen reist) rond de 50℃.
Speciale structuur
Hoe kan dit? De structuur van een watermolecuul, H₂O, is erg interessant en kan worden afgebeeld als een soort pijlpunt, met de twee waterstofatomen die het zuurstofatoom aan de bovenkant flankeren. De elektronen in het molecuul hebben de neiging om op een nogal asymmetrische manier te worden verdeeld, waardoor de zuurstofzijde negatief geladen wordt ten opzichte van de waterstofzijde. Dit eenvoudige structurele kenmerk leidt tot een soort interactie tussen watermoleculen die bekend staat als waterstofbinding, waarin de tegengestelde ladingen elkaar aantrekken.
Dit geeft watereigenschappen die, vaak, de trends die zijn waargenomen voor andere eenvoudige vloeistoffen doorbreken. Bijvoorbeeld, in tegenstelling tot de meeste andere stoffen, een vaste massa water neemt meer ruimte in beslag als vaste stof (ijs) dan als (vloeistof) door de manier waarop moleculen een specifieke regelmatige structuur vormen. Een ander voorbeeld is de oppervlaktespanning van vloeibaar water, dat is ongeveer het dubbele van dat van andere niet-polaire, eenvoudiger, vloeistoffen.
Water is eenvoudig genoeg, maar niet te simpel. Dit betekent dat een mogelijkheid om de schijnbare extra fase van water te verklaren, is dat het zich een beetje als een vloeibaar kristal gedraagt. De waterstofbruggen tussen moleculen houden wat orde bij lage temperaturen, maar uiteindelijk kan het even duren, minder geordende vloeibare fase bij hogere temperaturen. Dit zou de knikken kunnen verklaren die de onderzoekers in hun gegevens hebben waargenomen.
Indien bevestigd, de bevindingen van de auteurs kunnen veel toepassingen hebben. Bijvoorbeeld, als veranderingen in de omgeving (zoals temperatuur) veranderingen in de fysieke eigenschappen van een stof veroorzaken, dan kan dit mogelijk worden gebruikt voor detectietoepassingen. Misschien fundamenteler, biologische systemen zijn meestal gemaakt van water. Hoe biologische moleculen (zoals eiwitten) met elkaar interageren, hangt waarschijnlijk af van de specifieke manier waarop watermoleculen zich rangschikken om een vloeibare fase te vormen. Begrijpen hoe watermoleculen zich gemiddeld bij verschillende temperaturen rangschikken, zou licht kunnen werpen op de werking van hoe ze interageren in biologische systemen.
De ontdekking is een geweldige kans voor theoretici en experimentatoren, en een prachtig voorbeeld van hoe zelfs de meest bekende substantie nog steeds geheimen in zich heeft.
Dit artikel is oorspronkelijk gepubliceerd op The Conversation. Lees het originele artikel. 
 NASA analyseert regenval in nieuwe tropische storm Tapah
NASA analyseert regenval in nieuwe tropische storm Tapah Natuurbeschermers merken dat beschermde gebieden wereldwijd krimpen
Natuurbeschermers merken dat beschermde gebieden wereldwijd krimpen Typen Bobcats
Typen Bobcats  Wetenschappers noemen vier belangrijke acties om de opwarming van de aarde te stoppen
Wetenschappers noemen vier belangrijke acties om de opwarming van de aarde te stoppen Hoe transparanter zijn over hulpbronnen helpt om de CO2-uitstoot te verminderen
Hoe transparanter zijn over hulpbronnen helpt om de CO2-uitstoot te verminderen
Hoofdlijnen
- Nepal op schema om doel van verdubbeling tijgerpopulatie tegen 2022 te halen
- Het verzoenen van taxonveroudering met de Red Queens-hypothese
- Cat Chromosome Information
- Hoe hoogte te bepalen via het skelet
- Hoe voeden bacteriën?
- Draadtap op het dak is bedoeld om te leren waar kraaien over roddelen in de schemering
- Wat is de afbraak van mRNA?
- Griezelige bescherming:bedreigde diersoorten redden boven onze dode lichamen
- De centrale hoek vinden
- Milieuvriendelijke waterdichte polymeerfilms gesynthetiseerd met behulp van een nieuwe methode

- Het overwinnen van hindernissen bij het bewerken van CRISPR-genen om de behandeling te verbeteren
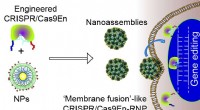
- Gelokaliseerde oxidatieve doding van tumorcellen door glasachtige ijzeren nanodeeltjes

- Hoe grootte van belang is voor katalysatoren:studielinks Grootte, Werkzaamheid, Elektronische eigenschappen

- Optica van koolstofnanobuisjes klaar om de weg te bieden naar optisch gebaseerde kwantumcryptografie en kwantumcomputing
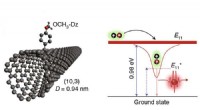
 Een stap dichter bij het aanraken van asteroïde Bennu
Een stap dichter bij het aanraken van asteroïde Bennu 2D-materialen en interfaces kunnen spinstroom omzetten in een vortex van laadstroom
2D-materialen en interfaces kunnen spinstroom omzetten in een vortex van laadstroom Grote schade aan stacaravanpark Alabama te midden van tropische storm
Grote schade aan stacaravanpark Alabama te midden van tropische storm Nieuwe film viert Hubble Space Telescope
Nieuwe film viert Hubble Space Telescope Draagt stop-and-search bij aan de verspreiding van COVID-19 in het VK?
Draagt stop-and-search bij aan de verspreiding van COVID-19 in het VK? Nieuwe NASA-radartechniek vindt verloren maanruimtevaartuig
Nieuwe NASA-radartechniek vindt verloren maanruimtevaartuig Australië geeft staatsacteur de schuld van het hacken van politieke partijen
Australië geeft staatsacteur de schuld van het hacken van politieke partijen Onderzoekers ontwikkelen methode om volledige 2D-circuits over te brengen naar elk glad oppervlak
Onderzoekers ontwikkelen methode om volledige 2D-circuits over te brengen naar elk glad oppervlak
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

