
Wetenschap
Nieuw aspect van atoomnabootsing voor nanotechnologietoepassingen
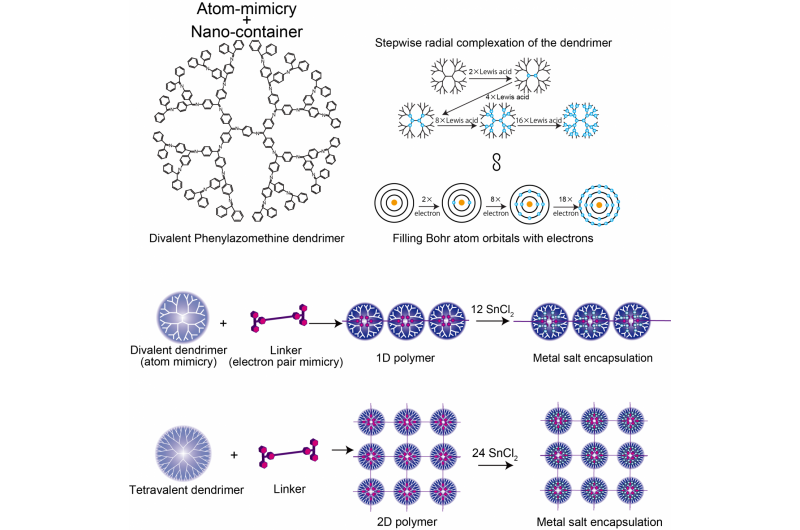
De structuur van tweewaardig Phenylazomenthine dendrimeer, Vergelijking van het DPA- en Bohr-atoommodel, en 1D/2D supramoleculaire polymeer. Krediet:Tokyo Institute of Technology
In nanotechnologie is controle de sleutel. Controle over de rangschikkingen en afstanden tussen nanodeeltjes kan op maat gemaakte interactiesterkten mogelijk maken, zodat eigenschappen kunnen worden benut in apparaten zoals plasmonische sensoren. Nu gebruiken onderzoekers van het Tokyo Institute of Technology dendrimeren die de elektronenvalentie van atomen nabootsen en ze koppelen aan arrays met behulp van moleculen die coördineren met het dendrimeer omdat ze een covalent elektronenpaar in hun valentieschil zouden vormen - "elektronenpaarmimicry".
Kimihisa Yamamoto, Ken Albrecht, en collega's van Tokyo Tech beschouwden de dendritische polyfenylazomethine (DPA), die een structuur heeft die vertakt vanuit een centrale kern. "Lewis-zuur"-moleculen coördineren met de "Lewis-base"-plaatsen van DPA. Analyse van de verhouding van SnCl2 Lewis-zuurmoleculen, gecoördineerd met elk dendrimeer, onthulde stapverhogingen van 2 naar 4 naar 8 naar 16, die de valentie nabootst van het Bohr-atoom dat 2 heeft, 8, 18, en 32 elektronen in de 1e, 2e, 3e, en 4e orbitalen. Dit weerspiegelt de toename van het aantal moleculen dat kan coördineren met het dendrimeer met toenemende afstand tot de kern, naarmate het aantal dendrimeertakken en elektronendichtheid toeneemt.
Yamamoto's team analyseerde de coördinatie van DPA met een sterker bindend Lewis-zuur - trifenylmethylium (TPM) - gebonden aan het staafachtige molecuul fenyleen-ethynyleen. De ruggengraat van fyleen-ethynleen is stijf genoeg zodat de zure kationen aan beide uiteinden niet aan hetzelfde dendrimeer kunnen binden. In plaats daarvan vormt zich een polymeerketen van dendrimeren. Het gebruik van een ander uitgangsdendrimeer (ZnPG4 in plaats van DPAG4) - met een kernvalentie van vier in plaats van twee - leidde tot de vorming van tweedimensionale polymerisatie van de dendrimeren, het produceren van een 2D-array van nanocontainers die andere Lewis-zuren in de buitenste orbitalen kunnen ophopen.
Het werk beschrijft "een nieuw aspect van atoommimicry", concluderen de onderzoekers. "De geometrie en toonhoogte kunnen worden gecontroleerd door het ontwerp van het dendrimeer en de linker en zijn mogelijk toepasbaar op plasmonics (na zaadgemedieerde groei) en nano-elektroderoosters (die ook bruikbaar zijn als elektrokatalysatoren)."
De studie is gepubliceerd in wetenschappelijke vooruitgang .
Bohr-atoom
Het Bohr-model van het atoom dat in 1913 door Niels Bohr en Ernest Rutherford is opgesteld, beschrijft het atoom als een positieve kern omringd door elektronen in verschillende schillen of energieniveaus. Elke schil heeft een voorgeschreven aantal elektronen dat het kan bezetten - dat wil zeggen, twee elektronen kunnen de eerste schil bezetten, acht de volgende, en achttien de volgende, enzovoort.
Hoewel er aspecten van het atoomgedrag zijn die het model niet behandelt, het is bijzonder succesvol in het verklaren van de spectrale emissielijnen. Wanneer opgewonden, een elektron kan naar het volgende energieniveau springen. Wanneer het terugkeert naar het oorspronkelijke energieniveau, het verschil in de energieën wordt uitgezonden als licht met de specifieke golflengte die overeenkomt met het energieverschil.
Waar een schaal niet vol is, het atoom kan binden met een andere chemische soort. Op deze manier beschrijft de valentie van een atoom hoe vol de elektronenschil is en hoe gemakkelijk bindingen kunnen worden gevormd. De elektronendichtheidsgradiënt van dendrimeren die radiaal van de kern naar de meer vertakte buitengebieden bewegen, bepaalt hoeveel Lewis-zuur-coördinerende moleculen het kan accommoderen en op deze manier bootst het de energieniveaus van het Bohr-atoom na.
Wat is een Lewis-zuur?
Een Lewis-zuur is een chemische soort die een alleenstaand elektronenpaar kan accepteren van een chemische stof die een alleenstaand paar kan doneren, dat is, van een Lewis-base. Dit gedrag wordt bepaald door de elektronenstructuur van de chemische stof. Lewis-zuren omvatten zure verbindingen maar ook metaalkationen.
Wanneer het dendrimeer coördineert met de Lewis-zuren, neemt het de plaats in van de Lewis-base die een elektronenpaar zou doneren. De onderzoekers beschrijven de di-Lewis-zuurverbinding (linkermolecuul) als elektronenpaar-nabootsing.
Isosbestische punten
Wanneer twee chemicaliën reageren, kan de hoeveelheid geabsorbeerd licht veranderen, afhankelijk van hoeveel licht de producten versus de reactanten absorberen. Als de producten en reactanten dezelfde hoeveelheid licht absorberen bij een bepaalde golflengte, het wordt beschreven als het isosbestische punt.
De onderzoekers gebruikten isosbestische punten om de stapverhogingen in Lewis-zuurreacties met de dendrimeren te identificeren. Een golflengteverschuiving in het isosbestische punt duidt op coördinatie van het Lewis-zuur met de volgende laag van het dendrimeer.
 Waterstofeconomie met massaproductie van zeer zuivere waterstof uit ammoniak
Waterstofeconomie met massaproductie van zeer zuivere waterstof uit ammoniak Het gebruik van de Venturi-meter
Het gebruik van de Venturi-meter  Veranderingen in de chiraliteit van moleculen in realtime observeren
Veranderingen in de chiraliteit van moleculen in realtime observeren Elektrische schok tot koolstof maakt een betere waterzuiveraar
Elektrische schok tot koolstof maakt een betere waterzuiveraar Nieuw record voor lengte koolstof-koolstof enkelvoudige binding
Nieuw record voor lengte koolstof-koolstof enkelvoudige binding
 Wat is forensische plantkunde?
Wat is forensische plantkunde?  Voedselwebben in bruinwatermeren zijn beter bestand tegen stikstofdepositie
Voedselwebben in bruinwatermeren zijn beter bestand tegen stikstofdepositie Waarom vormt condensatie zich op een drinkglas?
Waarom vormt condensatie zich op een drinkglas?  Het noordpoolgebied is in 3 miljoen jaar niet zo warm geweest – en dat voorspelt grote veranderingen voor de rest van de planeet
Het noordpoolgebied is in 3 miljoen jaar niet zo warm geweest – en dat voorspelt grote veranderingen voor de rest van de planeet Bio-kolen maken van plantaardig afval om klimaatverandering tegen te gaan
Bio-kolen maken van plantaardig afval om klimaatverandering tegen te gaan
Hoofdlijnen
- Is er een zaak tegen geluk?
- Critici slaan VS over import van olifantentrofeeën
- De rol van enzymen bij cellulaire ademhaling
- Wetenschapsprojecten: roken en de effecten ervan op de longen
- Wat zou er gebeuren als de cel geen DNA had?
- Beschrijving van gen-splitsing als een DNA-techniek
- Gentherapie kan kreupelheid bij paarden genezen, onderzoek vindt
- Nieuwe methode voor het planten van citrusvruchten stopt insecten, levert extra voordelen op
- Technologie verhoogt melkgift met 9 procent
- Nieuw nanodeeltje gemaakt van gewoon mineraal kan helpen tumorgroei op afstand te houden
- Onthulling van de mechanismen achter de verbetering van thermische eigenschappen van grafeen-nanovloeistoffen
- Karakterisering van de structuur van zelfassemblerende organische moleculen op het oppervlak van nanodeeltjes

- Demonstratie van hoogwaardige 2-D monolaagtransistoren op papieren substraten

- Grafeen komt de stratosfeer binnen

 Gratis datasetarchief helpt onderzoekers snel een speld in een hooiberg te vinden
Gratis datasetarchief helpt onderzoekers snel een speld in een hooiberg te vinden Opschudding in Turkije over het verwijderen van evolutie uit de biologieles
Opschudding in Turkije over het verwijderen van evolutie uit de biologieles El Nino onthult impact van opwarming van de aarde op mariene productie
El Nino onthult impact van opwarming van de aarde op mariene productie Vrees nemen toe dat China zeldzame aardmetalen zou kunnen gebruiken in de Amerikaanse tech-oorlog
Vrees nemen toe dat China zeldzame aardmetalen zou kunnen gebruiken in de Amerikaanse tech-oorlog Een mechanische trigger voor toxische tumortherapie
Een mechanische trigger voor toxische tumortherapie Onderzoekers ontdekken dat de meeste fantasiesporten gebaseerd zijn op vaardigheid, geen geluk
Onderzoekers ontdekken dat de meeste fantasiesporten gebaseerd zijn op vaardigheid, geen geluk Ariel gaat van blauwdruk naar realiteit
Ariel gaat van blauwdruk naar realiteit Neanderthalers waren eerder sprinters dan afstandlopers, studie suggereert verrassend:
Neanderthalers waren eerder sprinters dan afstandlopers, studie suggereert verrassend:
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

