Wetenschap
Wetenschappers maken fotoluminescente nanodeeltjes om kankercellen te markeren
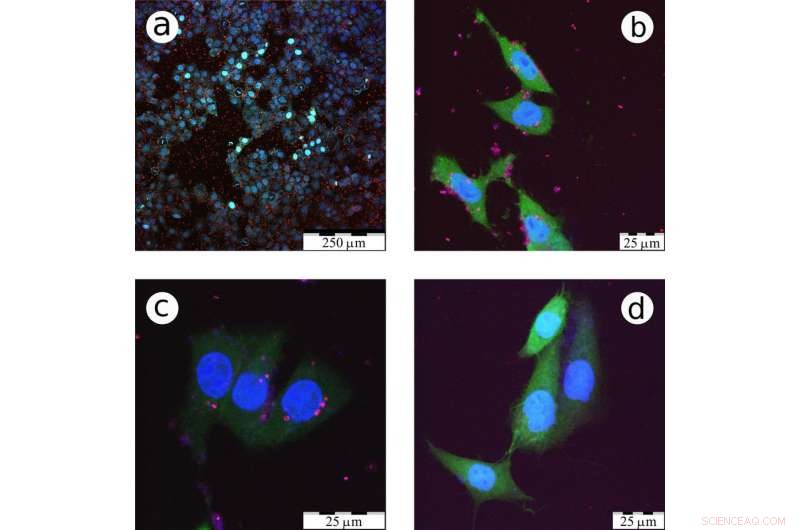
Dit zijn confocale fluorescentiemicroscopiebeelden van CF2Th-kankercellen die zijn geïncubeerd met LA-Si NP's. Krediet:Victor Timoshenko/ Wetenschappelijke rapporten
Een groep Russische en Franse onderzoekers, met de deelname van wetenschappers van de Lomonosov Moscow State University, heeft nanodeeltjes van ultrapuur silicium gesynthetiseerd die efficiënte fotoluminescentie vertonen, secundaire lichtemissie na foto-excitatie. Deze deeltjes drongen gemakkelijk door in kankercellen voor gebruik als lichtgevende markers bij de vroege diagnose en behandeling van kanker. De studie werd gepubliceerd in het tijdschrift Wetenschappelijke rapporten .
Volgens co-auteur Victor Timoshenko, eerdere pogingen in andere laboratoria waren niet succesvol, vooral omdat de nanodeeltjes werden gesynthetiseerd door chemische reacties in zure oplossingen. "De verkregen deeltjes waren niet zuiver genoeg, " zegt hij. "Bijproducten van de chemische reacties maakten ze giftig. Verder, deze nanodeeltjes hadden een vorm, die verre van een bol was, en het draagt niet bij aan het uiterlijk van de fotoluminescentie. Deze twee nadelen beperkten hun toepassingen ernstig."
Om deze tekortkomingen aan te pakken, de onderzoekers gebruikten een andere methode, zogenaamde laserablatie, die met een laserstraal atomen uit het doel werpt, zodat de gescheurde atomen een nanokristal vormen. Het probleem was dat de in dit geval gescheurde atomen vaak niet combineerden met deeltjes, maar met enkele willekeurige lagen, en zelfs als de nanodeeltjes werden verkregen, ze waren niet fotoluminescent. Ofwel waren de nanodeeltjes te groot, of ze koelden te snel af en hadden geen tijd om hoogwaardige nanokristallen te vormen. Dus, het was nodig om ze korte tijd te verwarmen om kristallisatie te bevorderen.
"Met dat doel, we besloten om korte, laserpulsen met hoge intensiteit, Professor Timoshenko zegt. "Ze wierpen niet alleen de siliciumatomen uit het doelwit, maar bovendien geïoniseerd. De uitgezonden elektronen leidden tot de ionisatie van heliumatomen die de atmosfeer omvatten waarin het zich voordeed. Binnen nanoseconden, laserplasma vormde de omstandigheden waardoor de atomen konden sinteren tot bolvormige nanokristallen. Deze kralen die op het oppervlak vallen, aggregeren als een pluizige laag, die vervolgens in water zou kunnen worden gedispergeerd."
Deze bolvormige nanodeeltjes hadden precies de juiste maat, twee tot vier nanometer in diameter, die zorgde voor efficiënte fotoluminescentie waarbij elk vallend foton werd uitgebalanceerd met één uitgestoten. In tegenstelling tot nanodeeltjes verkregen door chemisch etsen, ze hadden geen giftige toevoegingen nodig. En het belangrijkste, zoals aangetoond door biologische experimenten, ze konden gemakkelijk de cellen binnendringen. Bovendien, de nanosferen drongen veel gemakkelijker door in kankercellen dan gezonde. Dit komt omdat kankercellen altijd klaar zijn om zich te delen, en zo alles absorberen om dochtercellen te produceren. Volgens Victor Timosjenko, afhankelijk van het type cellen, kankercellen absorberen nanodeeltjes doorgaans 20 tot 30 procent efficiënter dan gezonde, die een basis vormt voor de diagnose van kanker in een vroeg stadium.
"Onze belangrijkste prestatie was het produceren van de nanodeeltjes en het vaststellen dat ze gemakkelijk in kankercellen doordringen, " Victor Timoshenko zei. "Het probleem van de diagnose is een aparte taak, die gelijktijdig door biologen werd opgelost, met onze deelname. Jij kan, bijvoorbeeld, vervang de analyse van biopsie, een vrij lange en onbetrouwbare 'ja-nee'-test, in plaats daarvan detecteren of een nanodeeltje een weefselmonster is binnengedrongen. Er zijn ook niet-invasieve diagnostische methoden. Het fotoluminescente licht dat door de nanodeeltjes wordt uitgezonden, is in dit geval moeilijk te gebruiken, maar ze kunnen op andere manieren worden geactiveerd, bijvoorbeeld ultrasone of radiofrequente elektromagnetische golven."
Het belangrijkste voordeel van de nanodeeltjes is dat ze volledig niet-toxisch zijn en gemakkelijk worden uitgescheiden. Ze kunnen ook binden aan specifieke stoffen of biomoleculen (bijv. antistoffen), waardoor artsen ze op kankercellen kunnen richten en daardoor de efficiëntie van de diagnose kunnen vergroten. Volgens Victor Timosjenko, in de toekomst kunnen deze nanodeeltjes zich ook binden aan medicijnen die niet alleen kanker opsporen, maar voer ook lokale chemotherapie of radiotherapie uit op cellulair niveau.
 Eenvoudige vergelijking leidt tot het creëren van schone-energiekatalysatoren
Eenvoudige vergelijking leidt tot het creëren van schone-energiekatalysatoren Machine learning-analyse van röntgengegevens selecteert belangrijke katalytische eigenschappen
Machine learning-analyse van röntgengegevens selecteert belangrijke katalytische eigenschappen Slimme simulaties brengen het gedrag van verrassende constructies in kaart
Slimme simulaties brengen het gedrag van verrassende constructies in kaart Stinkende huiden zorgen voor visachtige mode in Kenia
Stinkende huiden zorgen voor visachtige mode in Kenia Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
 250, 000 inwoners van Melbourne verliezen water door houtkap
250, 000 inwoners van Melbourne verliezen water door houtkap Hoe beschermen walvissen zichzelf?
Hoe beschermen walvissen zichzelf?  Zonlicht en de juiste microben zetten Arctische koolstof om in koolstofdioxide
Zonlicht en de juiste microben zetten Arctische koolstof om in koolstofdioxide Auto's ruilen voor deelfietsen kan tot 73 doden per jaar voorkomen
Auto's ruilen voor deelfietsen kan tot 73 doden per jaar voorkomen Een reeks rampen eist zware schade, menselijke tol in Azië
Een reeks rampen eist zware schade, menselijke tol in Azië
Hoofdlijnen
- Voorbeelden van diffusie in organen
- Mummies buikjes om de evolutie van de spijsvertering te onthullen
- Domme mensen zijn verrassend zelfverzekerd
- Marihuanaboerderijen stellen gevlekte uilen bloot aan rattengif in Noordwest-Californië
- Hoe schat ik de celgrootte met behulp van een microscoop?
- Bedwantsen proberen in je vuile was te komen
- Op bewijs gebaseerde tips om uw geheugen te verbeteren
- Door te bezuinigen op milieu-uitgaven, de overheid snijdt kansen
- De evolutionaire oorsprong van de darm
 Duitslands Continental verbiedt WhatsApp van werktelefoons
Duitslands Continental verbiedt WhatsApp van werktelefoons Getande reus scheurt door Alpen ondanks protesten spoorverbinding
Getande reus scheurt door Alpen ondanks protesten spoorverbinding De leeftijd van het ijs op de noordpool van Mars decoderen
De leeftijd van het ijs op de noordpool van Mars decoderen Het mechanische voordeel van Block & Tackle
Het mechanische voordeel van Block & Tackle  Evoluerende neurale netwerken met een lineaire groei in hun gedragscomplexiteit
Evoluerende neurale netwerken met een lineaire groei in hun gedragscomplexiteit Nanodots-doorbraak kan leiden tot een bibliotheek op één chip
Nanodots-doorbraak kan leiden tot een bibliotheek op één chip Tijd om een CO2-belasting op te geven?
Tijd om een CO2-belasting op te geven? Als het westen van de VS brandt, het Oosten wordt ook ziek
Als het westen van de VS brandt, het Oosten wordt ook ziek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com