
Wetenschap
Een (heel kleine) stap dichter bij de levering van kankermedicijnen op nanoschaal
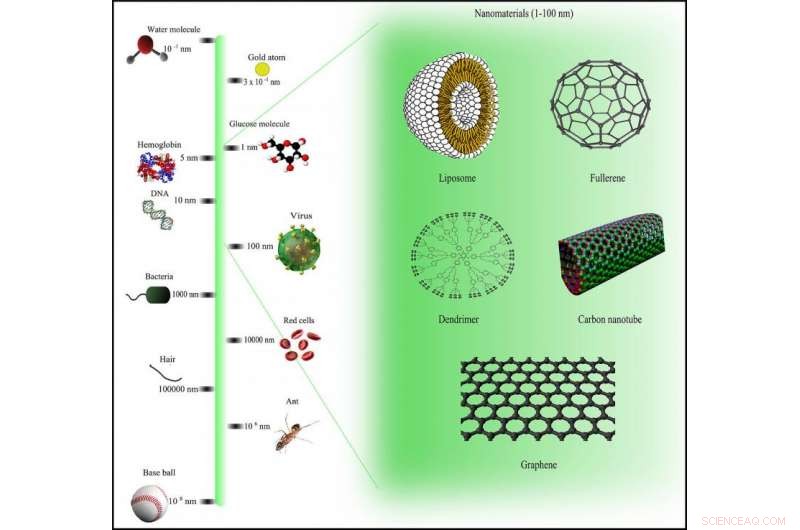
Vergelijkingsschaal voor nanomaterialen via Wikimedia Commons onder CC BY-SA 3.0-licentie
Als je een medicijn neemt, het reist door je bloedbaan, oplossen en dispergeren, en uiteindelijk het aangewezen doelgebied bereiken.
Maar omdat het bloed dat het medicijn bevat door uw hele lichaam reist, bereikt slechts een klein percentage van de initiële dosis daadwerkelijk de gewenste locatie.
Voor zelfzorggeneesmiddelen zoals paracetamol of ibuprofen, met zeer weinig bijwerkingen, dit maakt niet zoveel uit.
Maar als het gaat om medicijnen tegen kanker, die gezonde cellen net zo kunnen aantasten als kankercellen, dit proces kan grote problemen veroorzaken.
Mede doordat medicijnen in hun bloed worden verdund, kankerpatiënten moeten deze medicijnen in bijzonder hoge doses gebruiken – en dit kan ernstige onaangename bijwerkingen veroorzaken.
Maar professor Sonia Trigueros, co-directeur van het Oxford Martin-programma voor nanotechnologie, komt steeds dichter bij de ontwikkeling van een medicijnafgiftesysteem op nanoschaal met als doel specifiek kankercellen te targeten.
Werken met een team van chemici, ingenieurs en natuurkundigen, Trigueros is begonnen aan een ambitieuze missie om kanker aan te pakken op 'nano'-niveau - minder dan 100 nanometer breed. Voor de context, dit is superklein:een nanometer is een duizendste van een duizendste millimeter.
Er is nog een lange weg te gaan, maar Trigueros boekt behoorlijke vooruitgang, en heeft onlangs een groot probleem van werken op nanoniveau aangepakt. En op de Wired Health-conferentie van dit jaar, waarin werd gekeken naar de toekomst van de gezondheidszorg, welzijn en genomics - ze vertelde ons over haar recente vooruitgang, en haar visie op de toekomst.
Op nano-niveau
Sommigen van ons zullen zich het periodiek systeem herinneren dat in onze wetenschappelijke klaslokalen werd getoond en ons vertelde over de eigenschappen van elk element. Maar werkend op nano-niveau verandert alles, en elementen gedragen zich totaal anders.
Elementen hebben op nanoniveau andere eigenschappen dan op microniveau, legde Prof Trigueros uit aan het Wired Health 2015-publiek.
Dit levert grote problemen op voor onderzoekers die apparaten op nanoschaal proberen te maken, die kan worden gemaakt van een aantal verschillende materialen, inclusief goud, zilver en koolstof. Al deze materialen zijn zeer onstabiel op nanoniveau.
"Nadat je de nanostructuren hebt gemaakt, heb je slechts enkele minuten tot een paar dagen om te werken, "zei ze. Ze zijn echt onstabiel, vooral als je ze in water legt."
Dit is niet ideaal, gezien ons lichaam grotendeels uit water bestaat.
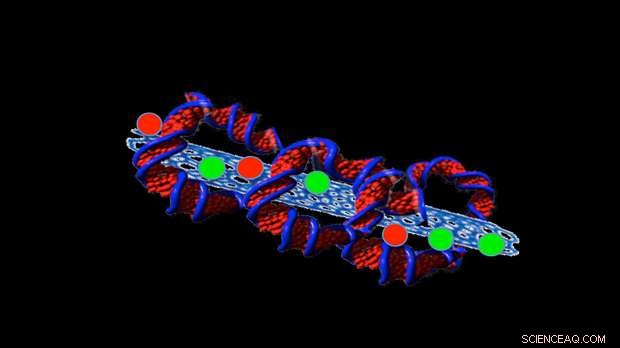
Krediet:Professor Sonia Trigueros
Het recente werk van Trigueros was gericht op het stabiliseren van kleine buisjes gemaakt van koolstof, genaamd koolstof nanobuisjes, die medicijnen in de buis houden, zodat ze in kankercellen kunnen worden afgeleverd.
Ze heeft nu een manier gevonden om ze meer dan twee jaar stabiel te houden en bij temperaturen tot 42ºC.
Om dit te doen, ze wikkelt DNA om de structuren, zoals een tortilla zich om de vulling van een burrito wikkelt.
Hoewel dit het doel bereikt om de nanostructuren stabiel in het lichaam te houden, heeft dit niet veel zin als het DNA zich niet kan uitpakken om de medicijnen af te geven. Maar, volgens Trigueros, ze heeft laten zien dat eenmaal in een cel, het DNA wikkelt zich gemakkelijk af en geeft zijn lading vrij.
Echt gerichte medicijnafgifte
Dus hoe werkt het allemaal? Hoe komen de medicijnen in de kankercellen? De nanobuisjes van Trigueros maken gebruik van de verschillen tussen kankercellen en gezonde cellen – in dit geval verschillen in de membranen die ze bij elkaar houden.
"Kankercellen zijn beter doorlaatbaar dan normale cellen, dus de nanobuisjes kunnen door het celmembraan komen. En als ze eenmaal binnen zijn, ze pakken het medicijn uit en leveren het af, " legde Trigueros uit.
Het benutten van verschillen in hun permeabiliteit is een manier om de kankercellen aan te pakken, maar Trigueros legt uit dat er meer dan één manier is om een echt gericht medicijnafgiftesysteem te creëren.
"We kunnen aan DNA bevestigen wat we willen, " zei ze. "Dus je kunt een eiwit vastmaken dat kankercellen herkent".
Van theorie naar realiteit
Hoewel dit in theorie allemaal geweldig klinkt, zal het in het echt werken?
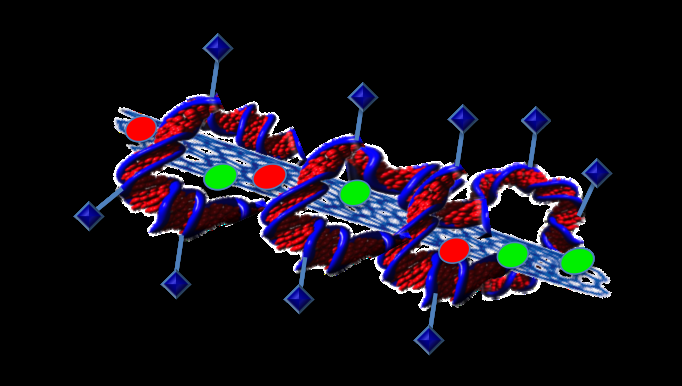
Door eiwitten aan DNA te hechten, zou een echt gericht medicijnafgiftesysteem kunnen ontstaan. Krediet:Professor Sonia Trigueros
Trigueros is nu begonnen met voorlopige tests op in het laboratorium gekweekte longkankercellen, vertelde ze ons tijdens een interview. En dit heeft een voorlopige belofte getoond, ze zegt, onder verwijzing naar niet-gepubliceerde gegevens over hun effectiviteit bij het doden van deze cellen in het laboratorium.
Anderen zijn voorzichtig optimistisch. "Dit is een heel spannend vooruitzicht, " says Professor Duncan Graham, nanotechnology expert and advisor to Cancer Research UK.
"A common concern with carbon nanotubes is toxicity, but when coated with DNA this concern could be removed, " he explains, "and it also addresses a fundamental issue, which is that they collect into clusters that become a solid mass and so are unable to leave the body."
In theorie, once Trigueros's nanotubes have finished their job they are tiny enough (50 nanometres) to be excreted through urine.
This isn't the first time carbon nanotubes have been used in cancer research:a US research team has used them, bijvoorbeeld, to target and collect images of tumours in mice. But the combination of drug delivery and cancer-specific targeting is what interests Professor Graham.
"Unlike previous work using carbon nanotubes, this approach is set to target the tumour specifically, potentially meaning fewer side effects and a lower dosage. I look forward to seeing this in animal models which is where the real proof of activity lies, " hij zei.
But he's cautious, stressing that Trigueros's work has not yet been peer-reviewed and published.
Volgende stappen
Next Trigueros is aiming towards starting animal trials and, eventually, she wants to begin clinical trials in patients – that is if everything goes well.
She hopes to focus on how nanostructures could be used to cross the blood-brain barrier – the brain's highly selective 'bouncer' that only lets certain molecules across. This has been notoriously difficult to get past, making targeting cancers in the brain more difficult.
But there is a still a long way to go and a lot of problems to tackle. In the shorter term, we'll be keeping an eager eye on her drug delivery research, as her ideas continue to develop.
 Hoe maak je een 1 procent BSA-oplossing
Hoe maak je een 1 procent BSA-oplossing Invoeging van boor in alkyletherbindingen via tandemkatalyse van zink/nikkel
Invoeging van boor in alkyletherbindingen via tandemkatalyse van zink/nikkel Nieuwe studie onthult dat protonhydratatiestructuren asymmetrisch zijn
Nieuwe studie onthult dat protonhydratatiestructuren asymmetrisch zijn Waarom moeten een buret en pipet worden gespoeld met de juiste oplossing voor een titratie?
Waarom moeten een buret en pipet worden gespoeld met de juiste oplossing voor een titratie?  Voors en tegens van synthetische polymeren
Voors en tegens van synthetische polymeren
 Europeanen alert terwijl hittegolf intensiveert (update)
Europeanen alert terwijl hittegolf intensiveert (update) Daycare Cleaning Checklist
Daycare Cleaning Checklist  Regenwoudmetropool werpt 1, 000 km schaduw op dieren in het wild
Regenwoudmetropool werpt 1, 000 km schaduw op dieren in het wild Klimaatbelastingen op landbouw kunnen leiden tot meer voedselonzekerheid dan klimaatverandering zelf
Klimaatbelastingen op landbouw kunnen leiden tot meer voedselonzekerheid dan klimaatverandering zelf Het achteraf aanpassen van ongebruikte ruimtes kan Zuid-Afrikaanse steden helpen zich aan te passen aan klimaatverandering
Het achteraf aanpassen van ongebruikte ruimtes kan Zuid-Afrikaanse steden helpen zich aan te passen aan klimaatverandering
Hoofdlijnen
- Hoe Dopamine sommige voedingsmiddelen verslavend maakt
- Hoe werkt een DP-cel?
- Welke cellen kunnen door het menselijk oog worden gezien?
- De illegale schildpaddenhandel - waarom wetenschappers geheimen bewaren
- Uitleg van celspecialisatie
- Wat gebeurt er in de interfase van de celcyclus?
- Biofysici ontrafelen de exacte vouwing van een enkel gen
- Hoe vogelgriep werkt
- Hoe de cellen van planten, dieren en eencellige organismen te vergelijken
- pH-gevoelige iridiumcomplexen als katalytische antikankerverbindingen
- Wetenschappers gebruiken scheikunde die de Nobelprijs heeft gewonnen voor doorbraak in schone energie

- Extreme duisternis:bos van koolstofnanobuizen bedekt de ultradonkere detector van NIST

- Point-of-care-test ontwikkeld voor tumormarker in menselijk speeksel op basis van lanthanide-nanoprobes
- Onderzoekers creëren goedkope, AI-aangedreven apparaat om optische spectra te meten
 Wetenschappers verklaren het fenomeen pseudocapaciteit in supercondensatoren
Wetenschappers verklaren het fenomeen pseudocapaciteit in supercondensatoren Conservatieve krachten: wat is het en waarom het ertoe doet (w /voorbeelden)
Conservatieve krachten: wat is het en waarom het ertoe doet (w /voorbeelden)  Een arbeider die vliegt:Chinese onderzoekers ontwerpen nieuwe vliegende robot
Een arbeider die vliegt:Chinese onderzoekers ontwerpen nieuwe vliegende robot Lockdown:misdaden in huis nemen toe - nieuwe maatregelen zijn nodig om de autoriteiten te waarschuwen
Lockdown:misdaden in huis nemen toe - nieuwe maatregelen zijn nodig om de autoriteiten te waarschuwen Methaan sijpelt in het Canadese hoge Noordpoolgebied
Methaan sijpelt in het Canadese hoge Noordpoolgebied Verbeterde microgrid-technologie:een nieuwe manier voor betrouwbare stroom
Verbeterde microgrid-technologie:een nieuwe manier voor betrouwbare stroom In welk soort leefomgeving leven krekels?
In welk soort leefomgeving leven krekels?  Hoe versnelling te berekenen met wrijving
Hoe versnelling te berekenen met wrijving
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

