
Wetenschap
Buckybomb toont potentiële kracht van explosieven op nanoschaal
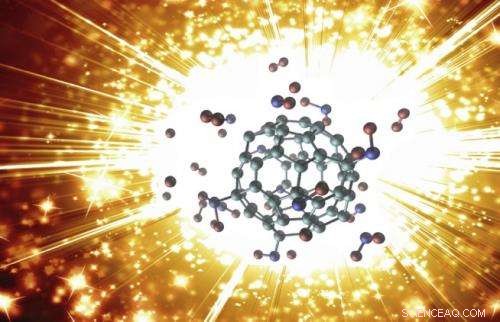
Moleculaire configuratie van een exploderende buckybomb. Krediet:ACS
(Phys.org)—Wetenschappers hebben de explosie van een gemodificeerd buckminsterfullereenmolecuul (C 60 ), beter bekend als een buckyball, en toonde aan dat de reactie binnen een fractie van een seconde een enorme toename van temperatuur en druk veroorzaakt. Het explosief op nanoschaal, die de wetenschappers een "buckybomb, " behoort tot het opkomende gebied van hoogenergetische nanomaterialen die een verscheidenheid aan militaire en industriële toepassingen kunnen hebben.
De onderzoekers, Vitaly V. Chaban, Eudes Eterno Fileti, en Oleg V. Prezhdo aan de Universiteit van Zuid-Californië in Los Angeles, hebben een artikel gepubliceerd over de gesimuleerde buckybomb-explosie in een recent nummer van The Journal of Physical Chemistry Letters . Chaban is ook verbonden aan de Federale Universiteit van São Paulo, Brazilië.
De buckybomb combineert de unieke eigenschappen van twee klassen materialen:koolstofstructuren en energetische nanomaterialen. Koolstofmaterialen zoals C 60 kunnen vrij gemakkelijk chemisch worden gewijzigd om hun eigenschappen te veranderen. In de tussentijd, NEE 2 Het is bekend dat groepen bijdragen aan detonatie- en verbrandingsprocessen omdat ze een belangrijke bron van zuurstof zijn. Dus, de wetenschappers vroegen zich af wat er zou gebeuren als NEE 2 groepen waren gehecht aan C 60 moleculen:zou het hele ding ontploffen? En hoe?
De simulaties beantwoordden deze vragen door de explosie stap voor stap te onthullen. Beginnend met een intacte buckybomb (technisch dodecanitrofullereen genoemd, of C 60 (NEE 2 ) 12 ), de onderzoekers verhoogden de gesimuleerde temperatuur tot 1000 K (700 °C). Binnen een picoseconde (10 -12 tweede), de nee 2 groepen beginnen te isomeriseren, hun atomen herschikken en nieuwe groepen vormen met enkele van de koolstofatomen van de C 60 . Naarmate er nog een paar picoseconden verstrijken, de C 60 structuur verliest een deel van zijn elektronen, die interfereert met de banden die het bij elkaar houden, en, in een oogwenk, het grote molecuul valt uiteen in vele kleine stukjes diatomisch koolstof (C 2 ). Wat overblijft is een mengsel van gassen inclusief CO 2 , NEE 2 , en N 2 , evenals C 2 .
Hoewel deze reactie een initiële warmtetoevoer vereist om op gang te komen, als het eenmaal draait, geeft het een enorme hoeveelheid warmte af voor zijn grootte. Binnen de eerste picoseconde, de temperatuur stijgt van 1000 tot 2500 K. Maar op dit punt is het molecuul onstabiel, dus extra reacties in de volgende 50 picoseconden verhogen de temperatuur tot 4000 K. Bij deze temperatuur, de druk kan oplopen tot 1200 MPa (meer dan 10, 000 keer normale atmosferische druk), afhankelijk van de dichtheid van het materiaal.
chemisch gesproken, de wetenschappers leggen uit dat de warmte-energie afkomstig is van de hoge dichtheid van covalente energie die wordt opgeslagen door de koolstof-koolstofbindingen in de C 60 . Omdat de NEE 2 groepen initiëren de reactie, meer NEE toevoegen 2 groepen verhoogt de hoeveelheid energie die vrijkomt tijdens de explosie. Het kiezen van een geschikt aantal van deze groepen, evenals het veranderen van de samengestelde concentratie, bieden manieren om de explosiesterkte te beheersen.
De onderzoekers voorspellen dat deze snelle afgifte van chemische energie opwindende mogelijkheden zal bieden voor het ontwerp van nieuwe hoogenergetische nanomaterialen.
© 2015 Fys.org
 Synthesestudies transformeren afvalsuiker voor toepassingen voor duurzame energieopslag
Synthesestudies transformeren afvalsuiker voor toepassingen voor duurzame energieopslag Kijk mam, geen handen:onderzoekers gebruiken vacuüm voor handsfree patroonvorming van vloeibaar metaal
Kijk mam, geen handen:onderzoekers gebruiken vacuüm voor handsfree patroonvorming van vloeibaar metaal Eigenschappen van Nylon
Eigenschappen van Nylon Ambrosia-verbindingen kunnen zenuwcellen beschermen tegen Alzheimer
Ambrosia-verbindingen kunnen zenuwcellen beschermen tegen Alzheimer Hoe verhouden een elementen Valence-elektronen zich tot hun groep in het periodiek systeem?
Hoe verhouden een elementen Valence-elektronen zich tot hun groep in het periodiek systeem?
 Miljard jaar oude meerafzetting levert aanwijzingen voor de oude biosfeer van de aarde
Miljard jaar oude meerafzetting levert aanwijzingen voor de oude biosfeer van de aarde Door de moessonoverstromingen zijn duizenden gestrand in India
Door de moessonoverstromingen zijn duizenden gestrand in India Onderzoekers bedenken microreactor om vorming van methaanhydraat te bestuderen
Onderzoekers bedenken microreactor om vorming van methaanhydraat te bestuderen Verwijdert bergtopverwijdering ook ratelslangen?
Verwijdert bergtopverwijdering ook ratelslangen? De manier waarop we onderzoek doen veranderen:pleiten voor duurzaamheidswetenschap
De manier waarop we onderzoek doen veranderen:pleiten voor duurzaamheidswetenschap
Hoofdlijnen
- Nieuw model bevestigt dat bedreigde rechtse walvissen afnemen
- Hoe wetenschappers de gezondheid van walvissen in de gaten houden door drones te gebruiken om hun slag op te vangen
- Who Discovered Ribosomes Structure?
- Een parasiet volgen die vissen verwoest
- Your Brain On: Exam Stress
- Een signaalroute die de vorming van een splitsingsgroef beperkt tot het middenvlak van de cel
- Nieuw apparaat zoomt in op microbengedrag op de juiste schaal
- Studie vindt toename van herbicide bij oudere volwassenen
- Onderzoekers leggen uit hoe slangen in een rechte lijn kunnen kruipen
- Fluorescerende peptide nanodeeltjes, in elke kleur van de regenboog

- Eenvoudige methode om verontreinigende stoffen in water te binden

- Team vindt Wigner-kristal - niet Mott-isolator - in grafeen met magische hoek
- Grafeensleutel voor nieuwe hardwarebeveiliging

- Microsponzen van zeewier kunnen levens redden (met video)

 Wat is het verschil tussen AGL & MSL?
Wat is het verschil tussen AGL & MSL?  Antibacteriële toepassingen van grafeenoxiden
Antibacteriële toepassingen van grafeenoxiden Antarctische ijskloof verspreidt zich:nieuwe tak onthuld in de nieuwste gegevens van ijsplaat
Antarctische ijskloof verspreidt zich:nieuwe tak onthuld in de nieuwste gegevens van ijsplaat Onderzoekers willen weten waarom beluga-walvissen nog niet zijn hersteld
Onderzoekers willen weten waarom beluga-walvissen nog niet zijn hersteld Is een koolstofvrije,
Is een koolstofvrije,  Zweedse oriëntatieloopliefhebber vindt schatkamer uit de bronstijd
Zweedse oriëntatieloopliefhebber vindt schatkamer uit de bronstijd Hoe wordt zonne-energie gebruikt?
Hoe wordt zonne-energie gebruikt?  Gigantische stellaire uitbarsting voor het eerst gedetecteerd
Gigantische stellaire uitbarsting voor het eerst gedetecteerd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

