
Wetenschap
Nieuwe kalibratieprocedure voor hersenbeeldvorming met superresolutie
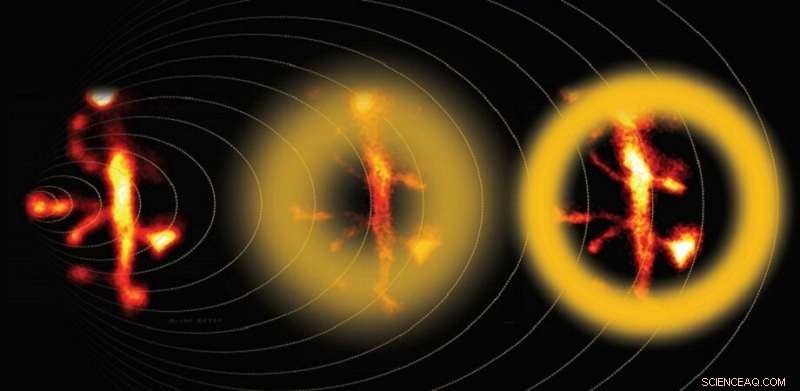
Multi-foton STED-microscopie verbeterd door adaptieve optica legt de fijne details van neuronale dendrieten vast. Krediet:Bancelin et al.
Licht - en alle golven - kunnen zich om de hoeken buigen van obstakels die op zijn pad worden gevonden. Door dit fenomeen, diffractie genoemd, het is onmogelijk om licht te focussen op een plek die kleiner is dan de helft van zijn golflengte. Met andere woorden, de hoogste resolutie die theoretisch kan worden bereikt met een optische microscoop is ongeveer 250 nm, een barrière die de diffractielimiet wordt genoemd. Helaas, deze resolutie is niet genoeg om fijne celstructuren waar te nemen, zoals die gevonden worden in neuronen.
Al meer dan een eeuw, microscopistes werden verlamd door deze klassieke barrière tot de uitvinding van superresolutie fluorescentiemicroscopie. Een bijzonder krachtige benadering werd eind jaren negentig ontwikkeld en bedacht 'gestimuleerde-emissiedepletie' (STED) microscopie. Deze techniek vereist dat het doelmonster fluoroforen bevat, Dit zijn verbindingen die licht op één golflengte absorberen en het vervolgens op een langere golflengte weer uitstralen. In de eenvoudigste versie van STED-microscopie, fluoroforen worden geëxciteerd op een cirkelvormige plek door bestraling met een diffractiebeperkte gefocusseerde laser. Vervolgens, een donutvormig gedeelte rond de plek wordt bestraald met minder-energetisch licht - de uitputtingsstraal - die de fluorescentie uitschakelt door het proces van gestimuleerde emissie. Dus, het netto-effect is dat alleen de fluoroforen in het midden van de donut fotonen opnieuw uitzenden. Aangezien dat gebied willekeurig klein kan worden gemaakt, dit maakt superresolutiemicroscopie mogelijk.
Hoewel STED-microscopie een echte doorbraak was voor het observeren van de morfologie van levende neuronen met een hogere resolutie, er is nog ruimte voor verbetering. In een recente studie gepubliceerd in Neurofotonica , een team van wetenschappers onder leiding van Dr. U. Valentin Nägerl van de Université de Bordeaux ontwikkelde een eenvoudige maar effectieve kalibratiemethode die nauwkeurigere STED-beeldvorming op grotere weefseldiepten mogelijk maakt. Hun aanpak is gebaseerd op het analyseren en corrigeren van een van de belangrijkste bronnen van systematische fouten in STED-microscopie voor biologische monsters:sferische aberratie van de uitputtingsstraal.
Bij het afbeelden van een weefselmonster op diepten hoger dan 40 m, de uitputtingsstraal lijdt aan verschillende soorten defocussering en degradatie (aberratie) en verliest zijn zorgvuldig vervaardigde vorm, wat essentieel is voor de STED-methode. Sferische aberratie is de grootste boosdoener en was het doelwit van de onderzoekers. Hun strategie was om eerst een hersenweefsel fantoommonster te maken, een op gel gebaseerde proxy met een brekingsindex die vergelijkbaar is met die van de eigenlijke hersenen. Dit fantoommonster bevatte homogeen gedispergeerde fluoroforen en gouden nanodeeltjes, waardoor het team duidelijk kon visualiseren en kwantificeren hoe de vorm van de uitputtingsstraal werd vervormd naarmate deze dieper doordrong. Vervolgens, ze berekenden de noodzakelijke vooraanpassingen die aan de uitputtingsstraal moesten worden gemaakt op basis van de weefseldiepte, zodat de uiteindelijke vorm beter overeenkomt met de ideale. De aanpassingen zijn gemaakt met behulp van adaptieve optica, dat is een technologie die oorspronkelijk door astronomen is ontwikkeld om telescopische beelden te verbeteren die last hebben van aberraties veroorzaakt door de atmosfeer van de aarde.
Nadat de vorm van de uitputtingsstraal was gekalibreerd volgens de fantoomtests, de wetenschappers gingen verder met het afbeelden van levend neuraal weefsel. Ze vergeleken de resultaten van reguliere STED-microscopie, gecorrigeerde STED-microscopie, en twee-fotonmicroscopie - een techniek die specifiek is aangepast voor beeldvorming van diep weefsel. De resultaten waren behoorlijk overtuigend:gecorrigeerde STED-beelden legden de fijne details van diepere neurale dendrieten veel beter vast dan standaard STED-beelden. "Met behulp van onze kalibratiestrategie, we konden neuronale structuren meten zo klein als 80 nm op een diepte van 90 μm in biologisch weefsel en een signaaltoename van 60 procent verkrijgen na correctie voor sferische aberratie, ’ zegt Nagerl.
Ji-Yi, hoogleraar biomedische technologie aan de Johns Hopkins University merkt op dat "superresolutiemicroscopie voornamelijk is toegepast voor dunne monsters, zoals enkellaagse cellen, waar lichtverstrooiing verwaarloosbaar is. Het team onder leiding van Valentin Nägerl implementeerde adaptieve optica in een door twee fotonen gestimuleerde emissiedepletiemicroscopie (2P-STED), en bereikte een resolutie van 80 nm van beeldvormende neuron dendritische stekels door 90 micron hersenweefsel. Dit is opmerkelijk omdat superresolutie moeilijk te handhaven is in dikker weefsel, vooral gezien de sterk verstrooiende kwaliteit van hersenweefsel." Yi legt uit dat de vooruitgang de studie van neurale activiteiten en interacties zal vergemakkelijken.
Aangezien dit nieuwe kalibratieproces robuust is, eenvoudig te implementeren, en relatief goedkoop, het zou gemakkelijk kunnen worden opgenomen in standaard laboratoriumpraktijken om betere resultaten te verkrijgen met STED-microscopen, zolang het voorbereide fantoommonster overeenkomt met de optische eigenschappen van het biologische monster. In dit verband, Nägerl stelt, "Onze benadering is niet beperkt tot hersenmonsters; het kan worden aangepast aan andere weefsels met bekende en relatief homogene brekingsindices, evenals andere soorten preparaten, zelfs mogelijk in de intacte, levend muizenbrein."
 Onderzoekers ontwikkelen nieuwe software voor het ontwerpen van duurzame steden
Onderzoekers ontwikkelen nieuwe software voor het ontwerpen van duurzame steden Hittegolven zijn dodelijker voor sommige steden dan andere - hier is waarom
Hittegolven zijn dodelijker voor sommige steden dan andere - hier is waarom Experts zeggen dat de uitbarsting van de Canarische Eilanden niet bijna ten einde is
Experts zeggen dat de uitbarsting van de Canarische Eilanden niet bijna ten einde is Nieuwe studie identificeert thermometer voor wereldwijde oceaan
Nieuwe studie identificeert thermometer voor wereldwijde oceaan George Monbiot Q + A - Hoe verjonging van de natuur de klimaatverandering kan helpen bestrijden
George Monbiot Q + A - Hoe verjonging van de natuur de klimaatverandering kan helpen bestrijden
Hoofdlijnen
- Ontmoet Afrika's vogelmeester van vocale imitatie
- Wat is een chromosoom?
- Robotapparaat volgt plantengroei op cellulair niveau
- Arbusculaire mycorrhiza-schimmelgemeenschappen blootgesteld met nieuwe benadering van DNA-sequencing
- Een stap dichter bij gewassen met twee keer de opbrengst
- Glycosylering - onbekend terrein in kaart brengen
- Sectie van DNA of RNA dat niet codeert voor eiwitten
- Uitleg van celspecialisatie
- Wat is een virus,
- Inches en ponden omzetten in centimeters en kilogram

- Kunstmatig massief mistmateriaal zorgt voor aangenaam laserlicht

- Onderzoekers realiseren kwantumteleportatie op mechanische beweging van siliciumstralen

- De punten verbinden voor kwantumnetwerken

- Hoe de ideale ingrediënten voor kernfusie met de meeste energie te berekenen?

 Yellow Prince-gitaar wordt verkocht voor $ 225, 000 in New York
Yellow Prince-gitaar wordt verkocht voor $ 225, 000 in New York Nieuwe aanwijzingen voor de oorsprong van mysterieuze atmosferische golven op Antarctica
Nieuwe aanwijzingen voor de oorsprong van mysterieuze atmosferische golven op Antarctica Koolstofnanobuisjes beloven verbeterde vlamwerende coating
Koolstofnanobuisjes beloven verbeterde vlamwerende coating Nieuwe warme Jupiter-exoplaneet ontdekt
Nieuwe warme Jupiter-exoplaneet ontdekt Parttime werkende moeders met flexibele schema's doen uiteindelijk meer werk zonder loon
Parttime werkende moeders met flexibele schema's doen uiteindelijk meer werk zonder loon Evolutionaire koppelingsanalyse identificeert de impact van ziektegerelateerde varianten
Evolutionaire koppelingsanalyse identificeert de impact van ziektegerelateerde varianten Warmte (natuurkunde): definitie, formule en voorbeelden
Warmte (natuurkunde): definitie, formule en voorbeelden Europese toeristenmagneten slaan terug nu Airbnb 10 wordt
Europese toeristenmagneten slaan terug nu Airbnb 10 wordt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

