
Wetenschap
Modulaire blauwe lichtgevoelige fotoschakelaar ontwikkeld voor optogenetische engineering
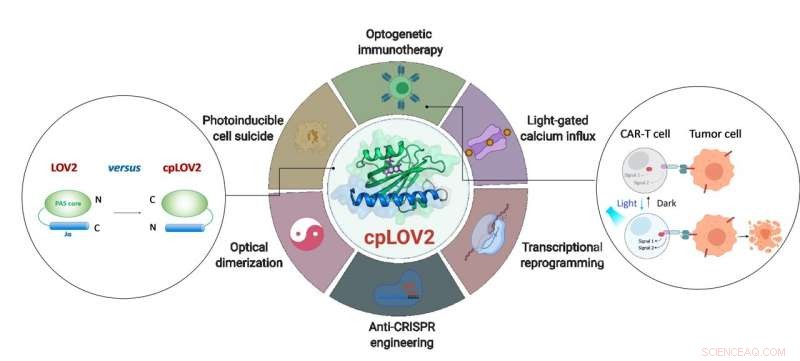
Het ontwerp van cpLOV2 en de uitgebreide toepassing ervan in optogenetische engineering. Krediet:ZHU Lei
Onlangs, Prof. WANG Junfeng van het High Magnetic Field Laboratory van de Hefei Institutes of Physical Science (HFIPS), samen met internationale wetenschappers, ontwikkelde een nieuwe circulaire gepermuteerde licht-zuurstof-voltage 2 (LOV2) om het repertoire van genetisch gecodeerde fotoschakelaars uit te breiden, die het ontwerp van nieuwe optogenetische apparaten zal versnellen. Het resultaat is gepubliceerd in Natuur Chemische Biologie .
LOV2-domein is een blauwe lichtgevoelige fotoschakelaar. In een typisch LOV2-gebaseerd optogenetisch apparaat, een effectordomein wordt gefuseerd na de C-terminale Jα-helix van LOV2, met de bedoeling de effector via sterische hindering in het donker te kooien. over fotostimulatie, door licht geactiveerde ontvouwing van de Jα-helix legt het effectordomein bloot om zijn functie te herstellen. Het maken van een op LOV2 gebaseerd fotoschakelbaar eiwit vereist vaak enorme technische inspanningen om elk onderdeel en de verbindende linker daartussen te optimaliseren. Daarom, het is wenselijk om de huidige optogenetische toolbox uit te breiden door nieuwe modules te creëren die deze stappen vereenvoudigen.
In dit onderzoek, de onderzoekers ontwierpen cpLOV2 met behulp van circulaire permutatie, een robuuste benadering van eiwitengineering die eerder werd gebruikt om nieuwe varianten van genetisch gecodeerde fluorescerende sondes en biokatalysatoren te ontwikkelen. De stikstof (N) en koolstof (C) uiteinden van cpLOV2 werden gecreëerd aan de N-terminus van Jα-helix, terwijl de oude werden verbonden door een glycine- en serine-rijke linker. Daarom, de effector zou kunnen worden gefuseerd vóór de N-terminale Jα van cpLOV2 naast de C-terminus in LOV2.
Met behulp van hoge resolutie NMR-spectroscopie en andere technieken, de onderzoekers toonden aan dat de structurele integriteit en functie van door licht geïnduceerde Jα-dissociatie van cpLOV2 goed behouden blijft. cpLOV2 werkte ook goed in LOVTRAP en verbeterde door licht geïnduceerde dimeer (iLid), beide zijn op LOV2 gebaseerde optische heterodimerisatiesystemen.
cpLOV2 bood meer keuzemogelijkheden voor optogenetische toepassingsontwikkelingen. De onderzoekers genereerden een reeks hybriden door LOV2 of cpLOV2 te fuseren met verschillende Ca 2+ kanaalactiverende en auto-inhibitiefragmenten afgeleid van stromale interactiemolecuul 1, en vond verschillende nieuwe op cpLOV2 gebaseerde optische actuatoren om ORAI1 Ca . te poorten 2+ kanaal, daarom toonden ze aan dat cpLOV2 zich nieuwe kooioppervlakken kon veroorloven om beperkingen die verband houden met wildtype LOV2 te overwinnen.
Omdat effectoren een vrij N-uiteinde nodig hadden om zijn volledige functie uit te voeren, cpLOV2 is een betere keuze. Een belangrijk eiwit dat betrokken is bij necroptose, mixed lineage kinase domain-like (MLKL) eiwit, was de succesvolle gekooide en ongekooide in cpLOV2-MLKL maar niet MLKL-LOV2 voor optische controle van celzelfmoord.
Chimere antigeenreceptor (CAR) T-celtherapie is naar voren gekomen als een veelbelovende immunotherapeutische benadering. Echter, de oncontroleerbare activiteit van CAR T-cellen tijdens de therapie zou ernstige bijwerkingen veroorzaken, b.v. cytokine-afgiftesyndroom bij sommige patiënten. Onderzoekers ontwierpen op cpLOV2 gebaseerde optische heterodimerisatiesystemen (cpLID), en geconstrueerde foto-afstembare split CAR (optoCAR). De therapeutische optoCAR T-cellen kunnen specifiek worden geactiveerd door CD19-tumorantigeen en blauw licht, en vervolgens vermenigvuldigen om CD19 te doden + Raji-lymfoomcellen.
In muismodel geïmplanteerd met CD19 + Raji-cellen, onderzoekers gebruikten upconversion-nanodeeltjes (UCNP's) om het nabij-infrarode licht met hoog weefselpenetratie om te zetten in blauw licht en de geïnjecteerde optoCAR T-cellen te activeren en bereikten een zeer effectieve therapie van lymfoomtumor. OptoCAR T-cellen die in deze studie zijn ontwikkeld, maken de spatiotemporele en omkeerbare controle van T-celactiviteiten en cytokineproductie mogelijk.
Deze bemoedigende resultaten suggereren dat optoCAR T-cellen mogelijke bijwerkingen kunnen verminderen zonder de therapeutische werkzaamheid te verliezen. In de toekomst, ze zijn van plan om optogenetische immunotherapie te proberen om verschillende soorten kanker te behandelen.
 Enzymcocktail ontwikkeld in Brazilië stimuleert de productie van ethanol van de tweede generatie
Enzymcocktail ontwikkeld in Brazilië stimuleert de productie van ethanol van de tweede generatie Biofilms als bouwvakkers
Biofilms als bouwvakkers Wetenschappers ontwikkelen een veilige, goedkope technologie voor desinfectie van verpakte eieren
Wetenschappers ontwikkelen een veilige, goedkope technologie voor desinfectie van verpakte eieren Welk deel van de nephron is verantwoordelijk voor de heropname van water?
Welk deel van de nephron is verantwoordelijk voor de heropname van water?  Kan een propaantank exploderen?
Kan een propaantank exploderen?
 Studie impliceert verder dat pluimveeverwerking betrokken is bij kustvervuiling
Studie impliceert verder dat pluimveeverwerking betrokken is bij kustvervuiling Bugs identificeren die hun huid afwerpen
Bugs identificeren die hun huid afwerpen Als water schaars is, we kunnen het ons niet veroorloven om de alternatieven voor ontzilting te verwaarlozen
Als water schaars is, we kunnen het ons niet veroorloven om de alternatieven voor ontzilting te verwaarlozen Lavastromen van de Indonesische berg Merapi in nieuwe uitbarsting
Lavastromen van de Indonesische berg Merapi in nieuwe uitbarsting Heeft een buitenaardse impact geleid tot het uitsterven van dieren uit de ijstijd?
Heeft een buitenaardse impact geleid tot het uitsterven van dieren uit de ijstijd?
Hoofdlijnen
- Grootste genetische studie van muggen onthult verspreiding van resistentie tegen insecticiden in Afrika
- Hoe een DNA-model te labelen
- Extra Y-chromosoom bij mannen
- Wat doen de Centrioles tijdens de interfase?
Centriolen vormen het microtubulekelet van de cel tijdens de interfase en dupliceren tijdens de S-fase van de interfase, samen met het DNA. Interphase bestaat uit de G1-, S- en G2-fasen. Centriolen komen
- Waarom het zo moeilijk is om schepen bij te houden die niets goeds doen?
- Het geheime leven van eilanddieren
- Rechtshandige gewoonte is misschien 2 miljoen jaar geleden begonnen
- Grootschalige aanpak onthult imperfecte actor in plantenbiotechnologie
- Beeldstabilisatie bij gewervelde dieren hangt af van contrast tussen objecten
- Gereedschappen gemaakt door mensen in het oude Mesopotamië

- Ultrasnel op laser gebaseerd schrijven van gegevens naar opslagapparaten
- De LEC - nu een efficiënt en helder apparaat

- 's Werelds eerste demonstratie van op spintronica gebaseerde kunstmatige intelligentie
- Doorbraak voor laser-geïnduceerde afbraakspectroscopie
 Appel, Broadcom veroordeeld tot betaling van $ 1,1 miljard voor inbreuk op octrooi
Appel, Broadcom veroordeeld tot betaling van $ 1,1 miljard voor inbreuk op octrooi Zowel duwen als trekken rijden onze melkwegstelsels door de ruimte
Zowel duwen als trekken rijden onze melkwegstelsels door de ruimte een dode, toeristen gestrand bij uitbarsting vulkaan Nieuw-Zeeland
een dode, toeristen gestrand bij uitbarsting vulkaan Nieuw-Zeeland Science Fair-onderwerpen met Glow Sticks
Science Fair-onderwerpen met Glow Sticks De Noordpool staat in brand, en het is ongeveer zo slecht als het klinkt
De Noordpool staat in brand, en het is ongeveer zo slecht als het klinkt  Bedrijven lopen risico op cyberaanvallen, maar nemen weinig voorzorgsmaatregelen
Bedrijven lopen risico op cyberaanvallen, maar nemen weinig voorzorgsmaatregelen Grafeen:het draait allemaal om de toppings
Grafeen:het draait allemaal om de toppings Mensenrechtengroep:werknemer doelwit van Israëlische spyware
Mensenrechtengroep:werknemer doelwit van Israëlische spyware
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

