
Wetenschap
Het foto-elektrisch effect in stereo
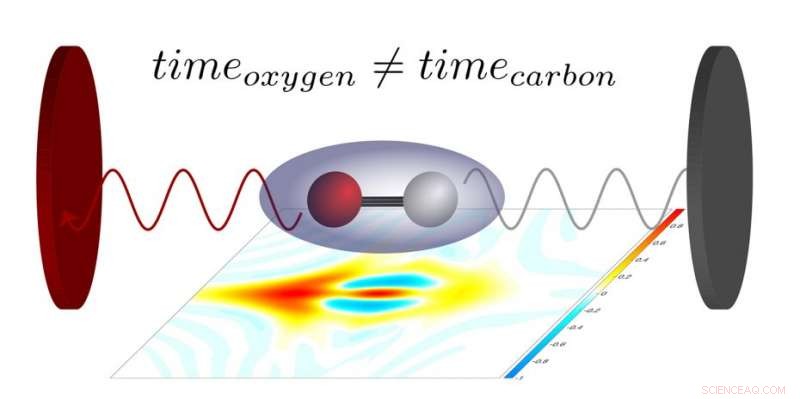
Afhankelijk van of het elektron zich dicht bij de zuurstof of bij het koolstofatoom bevindt, de laserpuls zal deze min of meer snel uitwerpen. Dat verschil kan nu precies worden gemeten. Krediet:ETH Zürich
In het foto-elektrisch effect, een foton werpt een elektron uit een materiaal. Onderzoekers van ETH hebben nu attoseconde laserpulsen gebruikt om de tijdsevolutie van dit effect in moleculen te meten. Uit hun resultaten kunnen ze de exacte locatie van een foto-ionisatiegebeurtenis afleiden.
Wanneer een foton een materiaal raakt, het kan er een elektron uitstoten, op voorwaarde dat het voldoende energie heeft. Albert Einstein vond de theoretische verklaring van dit fenomeen, wat bekend staat als het foto-elektrisch effect, in Bern tijdens zijn "jaar van wonderen" 1905. Die verklaring was een cruciale bijdrage aan de ontwikkeling van de kwantummechanica, die op dat moment aan de gang was, en het leverde hem in 1921 de Nobelprijs voor Natuurkunde op. Een internationaal team van natuurkundigen onder leiding van Ursula Keller van het Instituut voor Quantum Elektronica van de ETH Zürich heeft nu een nieuwe dimensie toegevoegd aan het experimentele onderzoek naar dit belangrijke effect. Met behulp van attoseconde laserpulsen konden ze een klein tijdsverschil meten in het uitwerpen van het elektron uit een molecuul, afhankelijk van de positie van het elektron in het molecuul.
"Geruime tijd, mensen hebben de tijdsevolutie van het foto-elektrisch effect in atomen bestudeerd", zegt Ph.D. leerling Jannie Vos, "maar er is tot nu toe heel weinig gepubliceerd over moleculen." Dat komt vooral doordat moleculen aanzienlijk complexer zijn dan losse atomen. In een atoom, het buitenste elektron dat rond de atoomkern beweegt, wordt in wezen uit zijn baan gekatapulteerd. In een molecuul, daarentegen, twee of meer kernen delen hetzelfde elektron. Waar het zich bevindt, hangt af van het samenspel tussen de verschillende aantrekkingskrachten. Hoe het foto-elektrisch effect precies onder dergelijke omstandigheden plaatsvindt, kon nu pas in detail worden bestudeerd.
Om dit te doen, Keller en haar collega's gebruikten koolmonoxidemoleculen, die uit twee atomen bestaan - een koolstofatoom en een zuurstofatoom. Die moleculen werden blootgesteld aan een extreem ultraviolette laserpuls die slechts enkele attoseconden duurde. (Een attoseconde is het miljardste deel van een miljardste van een seconde). De energie van de ultraviolette fotonen scheurde een elektron uit de moleculen, die vervolgens uiteenvielen in hun samenstellende atomen. Een van die atomen veranderde daarbij in een positief geladen ion. Met een speciaal instrument, de onderzoekers maten vervolgens de richtingen waarin de elektronen en ionen wegvlogen. Een tweede laserpuls, die als een soort meetlat fungeerde, stelde hen ook in staat om het precieze moment te bepalen waarop het elektron het molecuul verliet.
“Op deze manier konden we Voor de eerste keer, om de zogenaamde Stereo Wigner tijdvertraging te meten, " legt Laura Cattaneo uit, die als postdoctoraal onderzoeker in de groep van Keller werkt. De stereo Wigner-tijdvertraging meet hoeveel eerder of later een elektron het molecuul verlaat als het zich dicht bij het zuurstofatoom of het koolstofatoom bevindt wanneer foto-ionisatie plaatsvindt. De extreem korte laserpulsen maken het mogelijk om dat moment tot op enkele attoseconden te meten. Uit die informatie, beurtelings, het is mogelijk om de locatie van de ionisatiegebeurtenis binnen het molecuul te bepalen tot op een tiende van een nanometer. De experimentele resultaten komen goed overeen met theoretische voorspellingen die de meest waarschijnlijke positie van een elektron op het moment van foto-ionisatie beschrijven.
Volgende, de ETH-onderzoekers willen grotere moleculen onder de loep nemen, te beginnen met het lachgas N2O. Het extra atoom in dat molecuul maakt de theoretische beschrijving al een stuk lastiger, maar tegelijkertijd hopen de natuurkundigen nieuwe inzichten te verkrijgen, bijvoorbeeld in de zogenaamde ladingsmigratie binnen moleculen, die een belangrijke rol speelt in het chemische proces.
In principe zou het zelfs mogelijk moeten zijn om attoseconde laserpulsen te gebruiken, niet alleen om die processen te bestuderen, maar ook om ze bewust te sturen en zo chemische reacties tot in detail te beheersen. Direct, echter, zo'n atto-chemie is nog ver weg, zoals Jannie Vos opmerkt:"In theorie is dat allemaal heel spannend, maar er moet nog veel gebeuren voordat we zover zijn."
 Nieuwe technologie kan helpen water af te stoten, levens redden door verbeterde medische hulpmiddelen
Nieuwe technologie kan helpen water af te stoten, levens redden door verbeterde medische hulpmiddelen Een lage prijs, hoogrenderende katalysator die koolstofdioxide omzet in andere chemicaliën
Een lage prijs, hoogrenderende katalysator die koolstofdioxide omzet in andere chemicaliën Gras vervangt plastic in meeneemverpakkingen
Gras vervangt plastic in meeneemverpakkingen Door bacteriën gekweekte gebouwen:nieuw onderzoek om cellen in minifabriekjes voor materialen te veranderen
Door bacteriën gekweekte gebouwen:nieuw onderzoek om cellen in minifabriekjes voor materialen te veranderen Welk wasmiddel werkt het best voor een Science Fair-project?
Welk wasmiddel werkt het best voor een Science Fair-project?
 Mysterieuze gaten in Antarctisch zee-ijs verklaard door jarenlange robotgegevens
Mysterieuze gaten in Antarctisch zee-ijs verklaard door jarenlange robotgegevens Algen als levensvatbaar alternatief voor voedsel, diervoeder en verzorgingsproducten
Algen als levensvatbaar alternatief voor voedsel, diervoeder en verzorgingsproducten 10 Feiten over fotosynthese
10 Feiten over fotosynthese  Microplasticvervuiling stapelt zich zwaar op in kustgebieden zoals fjorden en estuaria
Microplasticvervuiling stapelt zich zwaar op in kustgebieden zoals fjorden en estuaria Onderzoekspaar suggereert opwarming van de aarde bijna volledig natuurlijk (update)
Onderzoekspaar suggereert opwarming van de aarde bijna volledig natuurlijk (update)
Hoofdlijnen
- Vier belangrijke typen chromosomen
- Zenuwonderzoek laat zien hoe cellen zich aanpassen om schade te helpen herstellen
- Zijn gelukkige mensen aardiger?
- Een verticale laminaire luchtstromingskap reinigen
- Onderzoekers schijnen de schijnwerpers op illegale handel in wilde orchideeën
- Elements of Nucleic Acids
- Nieuwe vissoorten vertonen opvallend kleurverschil tussen mannetjes en vrouwtjes
- Wat is de elektrische impuls die een Axon naar beneden beweegt?
- Wetenschappers rapporteren chemische basis van de celdelingstimer, een mogelijk doelwit tegen kanker
 De volgende generatie:muizen kunnen zich voortplanten na een verblijf in de ruimte, studie vondsten
De volgende generatie:muizen kunnen zich voortplanten na een verblijf in de ruimte, studie vondsten Hoe los ik H2O?
Hoe los ik H2O?  Onderzoek koppelt opvattingen van jongeren over politie aan kans op agressief gedrag
Onderzoek koppelt opvattingen van jongeren over politie aan kans op agressief gedrag Astronoom J. Allen Hynek
Astronoom J. Allen Hynek  Er is veel vraag naar datawetenschappers dankzij Big Data
Er is veel vraag naar datawetenschappers dankzij Big Data De eerste stap naar het kiezen van de juiste universiteit? Negeer de ranglijst
De eerste stap naar het kiezen van de juiste universiteit? Negeer de ranglijst Schokgolven gecreëerd in het laboratorium bootsen astrofysische deeltjesversnellers na die worden aangedreven door exploderende sterren
Schokgolven gecreëerd in het laboratorium bootsen astrofysische deeltjesversnellers na die worden aangedreven door exploderende sterren Baanbrekend instrument voor nucleaire magnetische resonantie analyseert nanostructuren zonder ze te vernietigen
Baanbrekend instrument voor nucleaire magnetische resonantie analyseert nanostructuren zonder ze te vernietigen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com






