Wetenschap
Röntgenlaser opent nieuwe kijk op Alzheimer-eiwitten
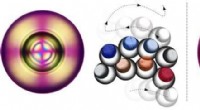
Een nieuwe experimentele methode maakt de röntgenanalyse van amyloïden mogelijk, een klasse van grote, filamenteuze biomoleculen die een belangrijk kenmerk zijn van ziekten zoals de ziekte van Alzheimer en Parkinson. Een internationaal team van onderzoekers onder leiding van DESY-wetenschappers heeft een krachtige röntgenlaser gebruikt om inzicht te krijgen in de structuur van verschillende amyloïdemonsters. De röntgenverstrooiing van amyloïde fibrillen geeft patronen die enigszins lijken op die verkregen door Rosalind Franklin uit DNA in 1952, wat leidde tot de ontdekking van de bekende structuur, de dubbele helix.
De röntgenlaser, biljoenen keren intenser dan Franklins röntgenbuis, opent de mogelijkheid om individuele amyloïde fibrillen te onderzoeken, de bestanddelen van amyloïde filamenten. Met zulke krachtige röntgenstralen kan elk vreemd materiaal het signaal van het onzichtbaar kleine fibrilmonster overweldigen. Ultradunne koolstoffilm - grafeen - loste dit probleem op om extreem gevoelige patronen vast te leggen. Dit markeert een belangrijke stap in de richting van het bestuderen van individuele moleculen met behulp van röntgenlasers, een doel dat structuurbiologen al lang nastreven. De wetenschappers presenteren hun nieuwe techniek in het tijdschrift Natuurcommunicatie .
Amyloïden zijn lang, geordende strengen van eiwitten die uit duizenden identieke subeenheden bestaan. Hoewel wordt aangenomen dat amyloïden een belangrijke rol spelen bij de ontwikkeling van neurodegeneratieve ziekten, recentelijk zijn er steeds meer functionele amyloïde vormen geïdentificeerd. "Het 'feel-good hormoon' endorfine, bijvoorbeeld, kunnen amyloïde fibrillen vormen in de hypofyse. Ze lossen op in individuele moleculen wanneer de zuurgraad van hun omgeving verandert, waarna deze moleculen hun doel in het lichaam kunnen vervullen, " legt Carolin Seuring van DESY uit, een wetenschapper bij het Center for Free-Electron Laser Science (CFEL) en de belangrijkste auteur van het artikel. "Andere amyloïde eiwitten, zoals die gevonden worden in postmortale hersenen van patiënten die lijden aan de ziekte van Alzheimer, accumuleren als amyloïde fibrillen in de hersenen, en kan niet worden afgebroken en daardoor de hersenfunctie op de lange termijn aantasten."
Wetenschappers proberen de ruimtelijke structuur van amyloïden zo nauwkeurig mogelijk te bepalen, om deze informatie te gebruiken om meer te weten te komen over hoe de eiwitfibrillen functioneren:"Ons doel is om de rol van de vorming en structuur van amyloïde fibrillen in het lichaam en in de ontwikkeling van neurodegeneratieve ziekten te begrijpen, " zegt Seuring bij het beschrijven van de motivatie van het team. "De structurele analyse van amyloïden is complex, en het onderzoeken ervan met behulp van bestaande methoden wordt belemmerd door verschillen tussen de fibrillen binnen een enkel monster." Het team gebruikte de röntgenvrije-elektronenlaser LCLS in het SLAC National Accelerator Center in de VS.
Een probleem is dat de strengen van amyloïden, bekend als fibrillen, kan niet worden gekweekt als kristallen, wat de gebruikelijke methode is om structurele studies met atomaire resolutie uit te voeren met behulp van röntgenstralen. Individuele amyloïde fibrillen zijn slechts enkele nanometers dik en daarom over het algemeen te klein om bij blootstelling aan röntgenstraling een meetbaar signaal te produceren. Om deze reden, de gebruikelijke benadering is om miljoenen van deze fibrillen parallel aan elkaar op te stellen, en bundelen ze zodat hun signalen optellen. Echter, dit betekent dat de diffractiepatronen door het hele ensemble worden geproduceerd, en informatie over structurele verschillen tussen de individuele fibrillen gaat verloren. "Een groot deel van ons begrip over amyloïde fibrillen is afgeleid van nucleaire magnetische resonantie (NMR) en cryo-elektronenmicroscopiegegevens, " legt Seuring uit. "Als je werkt met monsters die zo heterogeen zijn als amyloïden, Hoewel, en ook bij het observeren van de dynamiek van fibrilvorming, de bestaande methoden lopen tegen hun grenzen aan."
Om in de toekomst toegang te krijgen tot structuurinformatie van dergelijke heterogene steekproeven, het team koos voor een nieuwe experimentele aanpak. In plaats van de individuele amyloïden in een dragervloeistof te suspenderen, plaatsten de wetenschappers het op een ultradunne vaste drager gemaakt van grafeen, waarin koolstofatomen zijn gerangschikt in een hexagonaal patroon, vergelijkbaar met een atomaire honingraat. "Deze voorbeeldondersteuning heeft een dubbel voordeel, " zegt professor Henry Chapman van CFEL, die een hoofdwetenschapper is bij DESY. "Voor een ding, grafeen is slechts een enkele laag atomen dun en in tegenstelling tot een dragervloeistof winterhard laat een spoor achter in het diffractiepatroon. Voor een ander ding, de regelmatige structuur zorgt ervoor dat de eiwitfibrillen allemaal in dezelfde richting zijn uitgelijnd - tenminste in grotere domeinen." De diffractiepatronen van meerdere fibrillen overlappen en versterken elkaar, net als in een kristal, maar er is vrijwel geen storende achtergrondverstrooiing zoals in het geval van een dragervloeistof. Met deze methode kunnen diffractiepatronen worden verkregen uit minder dan 50 amyloïde fibrillen, zodat de structurele verschillen duidelijker naar voren komen. "We hebben karakteristieke asymmetrieën in onze gegevens waargenomen die suggereren dat onze techniek zelfs zou kunnen worden gebruikt om de structuur van individuele fibrillen te bepalen, ' zegt Suur.
"Het CXI-instrument bij LCLS leverde een uitzonderlijk helder, nanofocusstraal waarmee we gegevens uit zo'n klein aantal vezels konden extraheren, " meldt co-auteur Mengning Liang, een wetenschapper bij SLAC. "Fibrillen zijn een derde categorie monsters die op deze manier kunnen worden bestudeerd met röntgenlasers, naast enkele deeltjes en kristallen. In sommige opzichten, fibrillen passen tussen de andere twee:ze hebben regelmatige, terugkerende variaties in structuur zoals kristallen, maar zonder de stijve kristalstructuur."
De wetenschappers testten hun methode op monsters van het tabaksmozaïekvirus, ook voor het eerst onderzocht door Rosalind Franklin, en die filamenten vormt met een structuur die nu tot in detail bekend is. De test leverde inderdaad structurele gegevens over het virus op met een nauwkeurigheid van 0,27 nanometer (miljoensten van een millimeter) - wat overeenkomt met een resolutie bijna op de schaal van een enkel atoom. Het onderzoek van duidelijk kleinere amyloïde fibrillen gemaakt van endorfine en amyloïde fibrillen gemaakt van het hormoon bombesine, die onder andere betrokken is bij bepaalde vormen van kanker, gaf ook enige structurele informatie, met een nauwkeurigheid van 0,24 nanometer. Hoewel de gegevens onvoldoende waren om de volledige structuur te berekenen, de studie belooft veel voor structurele opvraging wanneer meer gegevens beschikbaar komen, en opent een nieuwe weg voor de structurele analyse van amyloïden met behulp van röntgenlasers. "Het is verbazingwekkend dat we zeer vergelijkbare experimenten uitvoeren als Franklin deed, maar bereiken nu het niveau van afzonderlijke moleculen, ' zegt Chapman.
 Supercondensator met snoepriet kan snel opladen van mobiele telefoons mogelijk maken
Supercondensator met snoepriet kan snel opladen van mobiele telefoons mogelijk maken Een nieuwe fluorescerende sonde die B-cellen van T-cellen kan onderscheiden
Een nieuwe fluorescerende sonde die B-cellen van T-cellen kan onderscheiden Dit is nanohout, een uitvinding die de ecologische voetafdruk van de mensheid zou kunnen verkleinen
Dit is nanohout, een uitvinding die de ecologische voetafdruk van de mensheid zou kunnen verkleinen Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld
Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld Onderzoek belicht vroegste deel van fasescheiding
Onderzoek belicht vroegste deel van fasescheiding
 bosbranden, geen pandemische lockdowns, had de grootste impact op het wereldwijde klimaat in 2020
bosbranden, geen pandemische lockdowns, had de grootste impact op het wereldwijde klimaat in 2020 Nederland roept op om gasproductie Groningen met bijna de helft te verminderen
Nederland roept op om gasproductie Groningen met bijna de helft te verminderen NASA-satellieten vinden windschering die orkaan Jose . treft
NASA-satellieten vinden windschering die orkaan Jose . treft Meer dan alleen afvoeren - herscheppen van levende stromen door de buitenwijken
Meer dan alleen afvoeren - herscheppen van levende stromen door de buitenwijken Nieuwe aanwijzingen voor kusterosie
Nieuwe aanwijzingen voor kusterosie
Hoofdlijnen
- Hoe de gecorrigeerde WBC-telling te berekenen
- Wetenschappers bundelen hun krachten om Puerto Ricos Monkey Island te redden
- Vissers in Istanbul houden traditie in stand ondanks voorraadalarm
- Hoe de hormonen van de hypofyse te onthouden
- Wat is opsomming in de microbiologie?
- Ezels hebben meer bescherming nodig tegen de winter dan paarden
- Hoe toxoplasmose immuuncellen uitbuit om de hersenen te bereiken?
- Wat zijn de zes soorten bindweefsel in de biologie?
Bindweefsel is een van de vier belangrijkste weefseltypen bij zoogdieren, de andere zijn zenuwweefsel, spierweefsel en epitheel of oppervlakteweefsel. Epitheliaal weefsel ligt op bindweefsel terwi
- De structuur en functie van spiercellen
 Dataverbruik je batterij leeg laten lopen? Klein apparaat om het geheugen te versnellen en tegelijkertijd energie te besparen
Dataverbruik je batterij leeg laten lopen? Klein apparaat om het geheugen te versnellen en tegelijkertijd energie te besparen Amerikaanse leraar roeit solo in recordtijd over Atlantische Oceaan
Amerikaanse leraar roeit solo in recordtijd over Atlantische Oceaan Nieuwe kwantumstructuren in supergekoeld helium kunnen de vroege dagen van het universum weerspiegelen
Nieuwe kwantumstructuren in supergekoeld helium kunnen de vroege dagen van het universum weerspiegelen Belangrijke feiten over Thomas Edison en de uitvinding van de gloeilamp
Belangrijke feiten over Thomas Edison en de uitvinding van de gloeilamp Hoge methaanuitstoot gevonden bij het composteren van verteerd voedselafval
Hoge methaanuitstoot gevonden bij het composteren van verteerd voedselafval Boeing verwacht MAX-productie voor medio 2020 te hervatten
Boeing verwacht MAX-productie voor medio 2020 te hervatten De meeste EU-landen missen luchtkwaliteitsdoelen:rapport
De meeste EU-landen missen luchtkwaliteitsdoelen:rapport Nieuw bewijs suggereert dat vulkanen de grootste massa-extinctie ooit hebben veroorzaakt
Nieuw bewijs suggereert dat vulkanen de grootste massa-extinctie ooit hebben veroorzaakt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Spanish | Norway |

-
Wetenschap © https://nl.scienceaq.com