
Wetenschap
Onderzoek belicht vroegste deel van fasescheiding
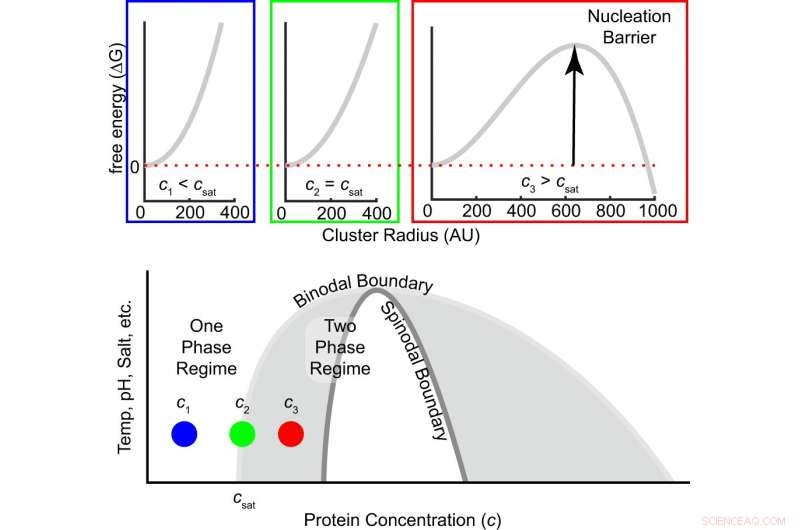
Fig. 1:De barrière voor vrije energie voor nucleatie hangt af van de mate van oververzadiging. De vrije energie als functie van de clustergrootte staat bovenaan voor drie concentraties, d.w.z., onderstaand, bij en boven de verzadigingsconcentratie. Naarmate de concentratie toeneemt van onderverzadigd naar de verzadigingsconcentratie naar oververzadigd, het teken van het vrije energieverschil tussen een molecuul binnen en buiten een cluster verandert van positief naar negatief, en er ontstaat een eindige nucleatiebarrière (vgl. (1)). Het grijze gebied binnen de binodale is metastabiel, wat betekent dat nucleatie nodig is om clusters met een dichte fase te vormen die groeien totdat evenwicht is bereikt. Het witte regime binnen de spinodale is onstabiel, wat betekent dat de oplossing spontaan ontleedt in verdunde en dichte fasen. Krediet:DOI:10.1038/s41467-021-24727-z
Wetenschappers van het St. Jude Children's Research Hospital bestuderen vloeistof-vloeistoffasescheiding (LLPS), een biofysisch proces waarbij eiwitten en nucleïnezuren in een cel zonder membraan worden gecompartimenteerd. Het werk geeft nieuw inzicht in hoe de kracht van de krachten die fasescheiding aandrijven, is gekoppeld aan de snelheid waarmee deze optreedt. De bevindingen zijn vandaag gepubliceerd in Natuurcommunicatie .
Cellen moeten eiwitten en andere componenten sorteren en organiseren. Een manier waarop ze dit doen is via LLPS, een proces vergelijkbaar met de manier waarop olie druppeltjes vormt in water. Membraanloze organellen, lichamen in een cel die zich gedragen als vloeistofdruppels, organiseren bepaalde eiwitten zonder ze te omsluiten met een membraan. In plaats daarvan, de eiwitten worden bij elkaar gehouden door de biofysische krachten die LLPS aandrijven.
Er is weinig bekend over hoe biomoleculen overgaan van een eenfasige oplossing naar een tweefasig mengsel, in een proces dat nucleatie wordt genoemd. Dit proces was een uitdaging om te evalueren, omdat er naar extreem snelle tijdschalen (microseconden tot milliseconden) moet worden gekeken. Als resultaat, de meeste studies hebben in plaats daarvan gekeken naar evolutie binnen systemen die zich al in het tweefasenregime bevinden (hoe druppeltjes samensmelten en groeien).
"We kunnen tijdens deze zeer vroege tijdstippen zien dat zelfs individuele ongeordende eiwitmoleculen die in fasen scheiden heel andere eigenschappen hebben dan ongeordende eiwitten die niet in fasen scheiden, " zei co-corresponderende auteur Tanja Mittag, doctoraat, St. Jude Afdeling Structurele Biologie.
Onderzoek in St. Jude en elders heeft aangetoond dat LLPS betrokken kan zijn bij neurodegeneratieve ziekten zoals amyotrofische laterale sclerose (ALS) en kanker. Een beter begrip van LLPS kan uiteindelijk leiden tot mogelijkheden om delen van het proces therapeutisch te richten.
Tijdmetingen in microseconden geven nieuw inzicht
De heersende opvatting van LLPS in de biologie is dat een verandering in cellulaire omstandigheden spontaan kan leiden tot kiemvorming, een eenfasige oplossing in twee fasen schakelen. In dit onderzoek, de wetenschappers gebruikten een vereenvoudigd systeem, met een enkel eiwit in water en zout, om te onderzoeken of de overstap daadwerkelijk op een dergelijke manier heeft plaatsgevonden of dat er aanvullende stappen nodig zijn om het proces een kickstart te geven.
Met een techniek die snel mengen wordt genoemd, tijd-opgelost, kleine-hoek röntgenverstrooiing (TR-SAXS), de onderzoekers waren in staat om de vroegste stadia van het proces te observeren. Ze onderzochten de kiemvorming van een prionachtig domein genaamd A1-LCD van het eiwit hnRNPA1. Mutaties van dit eiwit veroorzaken ALS en andere ziekten.
De wetenschappers lieten zien hoe clusters van A1-LCD vormen, en hoe deze clusters tot LLPS leiden. De bevindingen geven aan dat nucleatie verschillende stappen bevat, onderscheiden door de grootte van het cluster. Als we kijken naar de kleinste clusters (met weinig individuele moleculen), wetenschappers ontdekten dat het assemblagegedrag afweek van de klassieke nucleatietheorie. Deze afwijkingen verklaren mogelijk waarom fasescheiding van sommige biomoleculen in milliseconden kan gebeuren, terwijl het bij andere uren duurt.
"Zelfs in een vereenvoudigd systeem, je moet nog rekening houden met dit soort niet-ideale effecten in de vroege stadia van kiemvorming, " zei co-corresponderende auteur Erik Martin, doctoraat, St. Jude Afdeling Structurele Biologie. "Voordat je kunt gaan nadenken over fasescheidingsmontage of condensatie in cellen, je moet op moleculair niveau over dingen nadenken. Er zullen eerste stappen naar die assemblage zijn die niet in eerdere modellen zijn verwerkt."
 Snel gecontroleerd transport van waterdruppels door door zonlicht aangedreven pomp
Snel gecontroleerd transport van waterdruppels door door zonlicht aangedreven pomp Nieuwe katalysator opent de deur naar het afvangen van kooldioxide bij de omzetting van steenkool in vloeibare brandstoffen
Nieuwe katalysator opent de deur naar het afvangen van kooldioxide bij de omzetting van steenkool in vloeibare brandstoffen Verbindingen in een Aziatische gefermenteerde vispasta kunnen een hoog cholesterolgehalte verlagen
Verbindingen in een Aziatische gefermenteerde vispasta kunnen een hoog cholesterolgehalte verlagen Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk
Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk Verschillen tussen Borax en Borateem
Verschillen tussen Borax en Borateem
Hoofdlijnen
- Welke organismen voeren fotosynthese uit?
- Vreemde ondernemingen:mierenkoninginnen begraven doden om ziekte te voorkomen
- Wat zijn de primaire functies van fosfolipiden?
- Genotype & Phenotype Definitie
- Welke combinatie van chromosomen resulteert in een jongen?
- Morfogenese en de ontwikkeling van levende vormen
- Depolarisatie en herpolarisatie van het celmembraan
- Het hormoon dat uw hond agressief zou kunnen maken
- De geleidbaarheid van zenuwcellen in het centrale zenuwstelsel
- Wetenschappers ontwikkelen goedkope chip om aanwezigheid en hoeveelheid COVID-19-antilichamen te detecteren

- Kookchemie minus hitte is gelijk aan nieuwe niet-giftige lijm

- Video:De chemie van Hollywood-bloedbaden

- Wetenschappers kijken naar meteorieten voor inspiratie om een kritieke elementvrije magneet te bereiken

- Onderzoek breekt nieuwe wegen in om te begrijpen hoe een moleculaire motor kracht genereert
 De herontdekking van verloren werelden is een stap in de richting van het vinden van bewoonbare planeten
De herontdekking van verloren werelden is een stap in de richting van het vinden van bewoonbare planeten Interessante feiten over Baby Wolves
Interessante feiten over Baby Wolves Video:Proba-2s voorspelde weergave van de zonsverduistering van 2 juli
Video:Proba-2s voorspelde weergave van de zonsverduistering van 2 juli Een percentage berekenen met behulp van een rekenmachine
Een percentage berekenen met behulp van een rekenmachine  AI kan nu emoties lezen, maar zou dat ook moeten?
AI kan nu emoties lezen, maar zou dat ook moeten? Nieuwe tijdlijn van dodelijkste bosbrand in Californië kan levensreddend onderzoek en actie leiden
Nieuwe tijdlijn van dodelijkste bosbrand in Californië kan levensreddend onderzoek en actie leiden Microkrediet gebruiken om rijstopbrengst in Bangladesh te verhogen
Microkrediet gebruiken om rijstopbrengst in Bangladesh te verhogen Nanotech-bedrijf van de Universiteit van Houston wint de Goradia Innovation Prize
Nanotech-bedrijf van de Universiteit van Houston wint de Goradia Innovation Prize
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | French | Spanish |

-
Wetenschap © https://nl.scienceaq.com

