Wetenschap
Tetraëdrisch is de sleutel tot de uniciteit van water
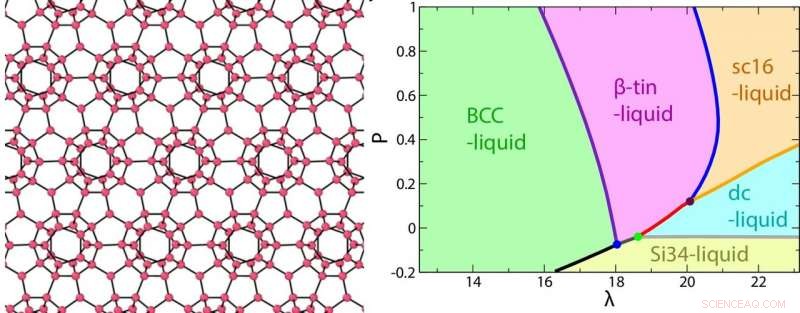
Een afbeelding van de clathraatstructuur (Si34) van een waterachtige vloeistof gevormd bij een negatieve druk (links) en het fasediagram als functie van de sterkte van tetraëdrisch λ en druk P. Credit:2018 Hajime Tanaka, Instituut voor Industriële Wetenschappen, De Universiteit van Tokio
Een in Japan gevestigd onderzoeksteam heeft het afwijkende gedrag van tetraëdrische vloeistoffen zoals water bestudeerd. Via computersimulatie, ze berekenden de fasediagrammen van een reeks modelvloeistoffen. Variëren met een parameter genaamd lambda (λ), die de hoeveelheid tetraëdrische structuur in de vloeistof regelt, ze ontdekten dat vloeistoffen met een grotere λ meer afwijkingen vertoonden, zoals expansie bij lage temperatuur. Water's waarde van λ maximaliseert het effect van tetraëdrische, vandaar zijn bijzonder ongebruikelijke eigenschappen.
Water heeft een speciale plaats onder vloeistoffen vanwege zijn ongewone eigenschappen, en blijft slecht begrepen. Bijvoorbeeld, het zet uit net bij het bevriezen tot ijs, en wordt minder viskeus onder compressie, rond atmosferische druk. Het rationaliseren van deze eigenaardigheden is een grote uitdaging voor natuurkunde en scheikunde. Recent onderzoek onder leiding van het Institute of Industrial Science (IIS) van de Universiteit van Tokyo suggereert dat ze het gevolg zijn van de mate van structurele ordening in de vloeistof.
Water behoort tot een klasse van vloeistoffen waarvan de deeltjes lokale tetraëdrische structuren vormen. De viervlakkigheid van water is een gevolg van waterstofbruggen tussen moleculen, die zijn beperkt tot vaste richtingen. In een studie in de Proceedings van de National Academy of Sciences ( PNAS ), de onderzoekers onderzochten waarom de fysische eigenschappen van water zoals uitgedrukt in het fasediagram zo opmerkelijk zijn, zelfs vergeleken met andere tetraëdrische vloeistoffen, zoals silicium en koolstof.
Tetraëdrische vloeistoffen worden vaak gesimuleerd door een energiepotentieel dat het SW-model wordt genoemd. Aangenomen wordt dat de vloeistof twee fasen in thermodynamisch evenwicht bevat:een wanordelijke toestand met een hoge rotatiesymmetrie, en een tetraëdrisch geordende staat die dat niet doet. Ondanks zijn eenvoud, het model voorspelt nauwkeurig afwijkend vloeistofgedrag. De eigenschap met twee toestanden wordt bestuurd door de parameter lambda (λ), die de relatieve sterkte van paarsgewijze en drie-lichamen intermoleculaire interacties beschrijft. Hoe hoger λ is, de graad van tetraëdrische orde neemt toe.
"We realiseerden ons dat λ, die vrij groot is voor water, was de sleutel tot het unieke karakter van deze vloeistoffen, " zegt co-hoofdauteur John Russo van de studie. "Effectief, λ regelt de mate van tetraëdrisch:naarmate λ toeneemt, tetraëdrische schillen die zich rond elk molecuul vormen, worden energetisch stabieler. Vandaar, deze schillen overwinnen het ongunstige verlies aan entropie dat gepaard gaat met het creëren van orde." De lokale tetraëders lijken op vaste-stofstructuren, daarom kristalliseren high-λ vloeistoffen gemakkelijker.
Door continu λ aan te passen, ze simuleerden een reeks fasediagrammen om te modelleren wat er gebeurt als een "eenvoudige" vloeistof steeds meer waterachtig wordt. Met toenemende λ, de verschillende thermodynamische en dynamische anomalieën van tetraëdrische vloeistoffen - zoals uitzetting bij lage temperatuur en het breken van de standaard Arrhenius-wet voor diffusie - werden meer uitgesproken.
Echter, het was niet zo eenvoudig als "meer tetraëders is gelijk aan vreemder gedrag." De invloed van tetraëdrisch was gemaximaliseerd voor water, die heeft λ =23,15. Hierboven, het gedrag van de dichtheid als functie van de temperatuur naderde weer normaal, omdat het verschil in volume tussen geordende en ongeordende toestanden begon af te nemen. Dus, water heeft een prachtig verfijnde of "Goldilocks" -waarde van λ waardoor het gemakkelijk kan schakelen tussen orde en willekeur. Dit geeft het een hoge structurele flexibiliteit in reactie op veranderende temperatuur of druk, wat de oorsprong is van zijn unieke gedrag.
"Waarneembare eigenschappen koppelen, zoals viscositeit tot microscopische structuren, is waar het bij fysische chemie om draait, "Co-lead auteur Hajime Tanaka zegt. "Water, de meest voorkomende en toch meest ongewone stof op aarde, is in dit opzicht lange tijd de laatste grens geweest. We waren verheugd dat een eenvoudige, bekend model kan de vreemdheid van water volledig verklaren, die voortkomt uit het delicate evenwicht tussen orde en wanorde in de vloeistof."
 Fracking heeft minder impact op het grondwater dan traditionele olie- en gasproductie
Fracking heeft minder impact op het grondwater dan traditionele olie- en gasproductie Tyfoon verzwakt maar kan Japan nog steeds bedreigen
Tyfoon verzwakt maar kan Japan nog steeds bedreigen Bevriezen in record dieptepunten? Je twijfelt misschien aan de opwarming van de aarde, zegt wetenschapper
Bevriezen in record dieptepunten? Je twijfelt misschien aan de opwarming van de aarde, zegt wetenschapper Wetenschappers porren een gat in de leeftijd van bomen
Wetenschappers porren een gat in de leeftijd van bomen De Noordelijke IJszee was bedekt met een plankijs en gevuld met zoet water
De Noordelijke IJszee was bedekt met een plankijs en gevuld met zoet water
Hoofdlijnen
- Krachten van spinnengif onderzocht in VR-game
- Bio-ingenieurs ontdekken mechanisme dat krachtpatsers van cellen reguleert
- Hoe chromosomen vals spelen om kans te maken in een ei te komen
- Biosfeer: definitie, hulpbronnen, cycli, feiten en voorbeelden
- Wat zijn de vijf onderverdelingen van koninkrijken?
- Huidige vee-injecties verhogen het risico op letsel, onderzoek vindt
- Oud skelet-DNA suggereert genetische link met eerste mensen in Noord-Amerika
- Zijn mannen gewelddadiger dan vrouwen?
- Wat doet de temporale kwab?
 Wetenschappers zeggen dat de kosten van het afvangen van CO2 afnemen
Wetenschappers zeggen dat de kosten van het afvangen van CO2 afnemen NASA-NOAA satellietvolgsysteem tropische cycloon Kenanga
NASA-NOAA satellietvolgsysteem tropische cycloon Kenanga Hoe heet zijn atomen in de schokgolf van een exploderende ster?
Hoe heet zijn atomen in de schokgolf van een exploderende ster? Niet nu, nooit:Werken met huiselijk geweld
Niet nu, nooit:Werken met huiselijk geweld Google schikt met arbeidsbureau over toespraak van werknemer
Google schikt met arbeidsbureau over toespraak van werknemer Wat zijn convergente, divergerende en transformerende grenzen?
Wat zijn convergente, divergerende en transformerende grenzen?  Het bouwen van een maanbasis is een enorme taak, maar deze kleine satellieten zullen de weg vrijmaken
Het bouwen van een maanbasis is een enorme taak, maar deze kleine satellieten zullen de weg vrijmaken GIMPS-project ontdekt grootste bekende priemgetal
GIMPS-project ontdekt grootste bekende priemgetal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com