
Wetenschap
Eenvoudige techniek zorgt voor nauwkeurige computersimulaties van calciumsignalering
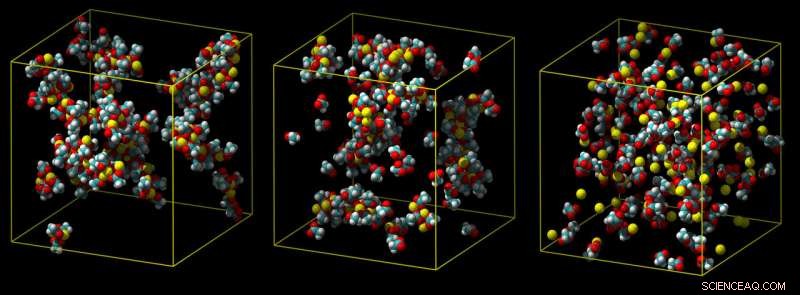
Een standaard calciummodel overschat hoe sterk calcium bindt, wat leidt tot klompjes ionenparen (links). Een tussenmodel vertoont minder klontering (midden), en een verfijnd ladingsschaalmodel voorspelt correct een zwakke associatie met carboxylgroepen in water (niet getoond) (rechts). Krediet:Philip Mason en Elise Duboue-Dijon
Calcium is essentieel voor ons lichaam om te functioneren. Calciumionen zorgen ervoor dat cellen met elkaar kunnen communiceren, neuronen laten interageren, spieren om samen te trekken, en de spiercellen van het hart om te synchroniseren en te kloppen. Om deze processen beter te begrijpen, waarin calciumionen interageren met biologische moleculen zoals eiwitten, onderzoekers maken vaak gebruik van computersimulaties. Maar nauwkeurige modellen zijn uitdagend en rekenkundig duur.
"Als je het verkeerde calciummodel hebt, het gaat gewoon niet lukken, " zei Pavel Jungwirth van het Instituut voor Organische Chemie en Biochemie van de Tsjechische Academie van Wetenschappen in Praag. "De meeste beschikbare modellen zijn niet nauwkeurig genoeg om de belangrijke kenmerken van het calciumion vast te leggen."
In het nummer van deze week van The Journal of Chemical Physics , echter, De onderzoeksgroep van Jungwirth laat zien hoe een eenvoudige wijziging in een computermodel leidt tot zeer nauwkeurige simulaties, die dienen als krachtige hulpmiddelen voor het bestuderen van een reeks biologische processen. "Ik geloof dat we op dit moment de beste van de eenvoudige modellen van calcium ter wereld hebben, ' zei Jungwirth.
Calciumionen reizen van cel naar cel als boodschappers. Als ze een cel bereiken, ze binden aan een molecuul, zoals een eiwit, veroorzaakt een cascade van chemische reacties. Maar vanwege de waterige omgeving van het ion, precies simuleren hoe calcium bindt, is moeilijk.
Het calciumion, die dubbel positief geladen is, interageert sterk met de zuurstof van de omringende watermoleculen. Deze zuurstofatomen hebben een gedeeltelijk negatieve lading (zoals in het watermolecuul) en het zuurstofatoom trekt de elektronen van de bindingen effectiever aan. De elektrostatische krachten tussen calcium en water zorgen ervoor dat de watermoleculen zich herschikken rond het ion. Het calciumion dwingt ook de elektronen in het watermolecuul te verschuiven, een fenomeen dat elektronische polarisatie wordt genoemd.
De meeste simulaties bevatten de herschikking van watermoleculen. Maar omdat berekenen hoe elektronen precies bewegen te veel rekenkracht vereist, ze houden geen rekening met elektronische polarisatie. Zonder elektronische polarisatie, Jungwirth zei, simulaties met calcium zijn onnauwkeurig.
Typisch, interacties met watermoleculen werken om een calciumion weg te trekken van het molecuul waarmee het probeert te binden, als in een moleculair touwtrekken. Als een simulatie niet volledig rekening houdt met deze effecten, het overschat hoe sterk het calcium bindt, het produceren van ionen die niet kunnen ontbinden, wat onrealistisch is.
Een paar jaar geleden, echter, Alexei Stuchebrukhov en Igor Leontyev stelden een oplossing voor:verlaag de elektrische lading van de ionen in de simulaties. Het blijkt dat het schalen van de lading met een factor van ongeveer 0,75 het effect van elektronische polarisatie nabootst. Zo'n eenvoudige schaling voegt ook geen extra rekenlast toe.
"Het is bijna een wonder, " zei Jungwirth. "We weten dat het geen perfecte oplossing is, maar misschien lost het 90 procent van het probleem op."
Eerder, Het team van Jungwirth testte de strategie door de relatief eenvoudige interactie tussen calcium- en chloride-ionen te modelleren. Om te controleren of de simulaties nauwkeurig waren - en of de schaalvergroting werkte - beschoten ze echte calciumchloride-oplossingen met neutronen. Door te meten hoe die neutronen zich van het waterige calciumchloride verspreidden, de onderzoekers leidden de structuur af en vergeleken de gegevens met de simulaties.
In de nieuwe studie de onderzoekers testten hun model met carboxylgroepen - moleculaire groepen die voorkomen in eiwitten, en dus relevanter voor de biologie. Nadat ook de lading van de carboxylgroep is aangepast, ze toonden opnieuw aan dat hun simulaties heel goed overeenkwamen met gegevens van experimenten met neutronenverstrooiing.
Omdat carboxylgroepen eenvoudig zijn in vergelijking met, zeggen, een heel eiwit, de onderzoekers konden de calciuminteracties ook beschrijven met behulp van nauwkeurige maar rekenkundig dure elektronische structuurberekeningen. Door deze berekeningen te vergelijken met de simulaties, ze bevestigden opnieuw de nauwkeurigheid van hun modellen.
Deze tests tonen aan dat het nieuwe model calciuminteracties met bijna elk eiwit kan simuleren, zei Jungwirth. De onderzoekers hebben ook een analoog model ontwikkeld dat werkt voor calciuminteracties met fosfolipiden op het celmembraan. De volgende stap, hij zei, is om hetzelfde te doen met DNA- en RNA-moleculen. En verderop, de onderzoekers zijn van plan een soortgelijk model voor magnesium te ontwikkelen, een ander belangrijk signaleringsion met zijn eigen unieke uitdagingen.
 Vernietiging door duizend sneden:de meedogenloze bedreiging die mijnbouw vormt voor het culturele landschap van Pilbara
Vernietiging door duizend sneden:de meedogenloze bedreiging die mijnbouw vormt voor het culturele landschap van Pilbara Gemummificeerde pinguïns vertellen over dodelijk weer in het verleden en de toekomst
Gemummificeerde pinguïns vertellen over dodelijk weer in het verleden en de toekomst Milieurisico's in de woestijnen
Milieurisico's in de woestijnen  Vluchten geannuleerd omdat tyfoon Tapah Japan nadert
Vluchten geannuleerd omdat tyfoon Tapah Japan nadert Typen bedreigde regenwoudplanten
Typen bedreigde regenwoudplanten
Hoofdlijnen
- Hoe wordt een zuivere cultuur direct voorbereid?
- Een boom die zichzelf bezit, groeit in Athene,
- mRNA: definitie, functie en structuur
- De centrale hoek vinden
- De voordelen van het bestuderen van cellen onder een lichtmicroscoop
- Onderzoek toont aan dat plantengroeiregulatoren gunstig kunnen zijn voor de vestiging van uien, productie
- Dode bomen leven met schimmels
- Hoe meet je geluk?
- Heeft Kelp veel verschillende cellen?
- Stop-motionfotonen:gelokaliseerde lichtdeeltjes op de weg

- Chocolade uitgepakt - wat zit er in je paastraktatie?
- Een recycling verkrijgen Bin

- Onderzoekers ontwikkelen een eerste-principes kwantum Monte Carlo-pakket genaamd TurboRVB
- Ontploffing, impactsimulaties kunnen leiden tot een beter begrip van verwondingen en kogelvrije vesten

 NASA vindt windschering die de tropische storm Josephine beïnvloedt
NASA vindt windschering die de tropische storm Josephine beïnvloedt Waarom Canadese vaders meer betrokken zijn bij het opvoeden van hun kinderen dan Amerikaanse vaders
Waarom Canadese vaders meer betrokken zijn bij het opvoeden van hun kinderen dan Amerikaanse vaders Spectroscopie met zes golflengten kan nieuwe details van het oppervlak van Venus opleveren
Spectroscopie met zes golflengten kan nieuwe details van het oppervlak van Venus opleveren Troef, onder druk, tekent Covid-noodwet van $ 900 miljard
Troef, onder druk, tekent Covid-noodwet van $ 900 miljard Is Facebook een bank? Congres dringt aan op antwoorden op crypto-inval
Is Facebook een bank? Congres dringt aan op antwoorden op crypto-inval Ondergrondse defecten bekijken terwijl ze bewegen
Ondergrondse defecten bekijken terwijl ze bewegen 3D-simulatie helpt bij het onthullen van het accretieproces in voorloper van tychos-supernova
3D-simulatie helpt bij het onthullen van het accretieproces in voorloper van tychos-supernova Nieuw wiskundig model laat zien hoe diversiteit consensus versnelt
Nieuw wiskundig model laat zien hoe diversiteit consensus versnelt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

