
Wetenschap
Nieuwe microscopiemethode doorbreekt de kleurbarrière van optische beeldvorming
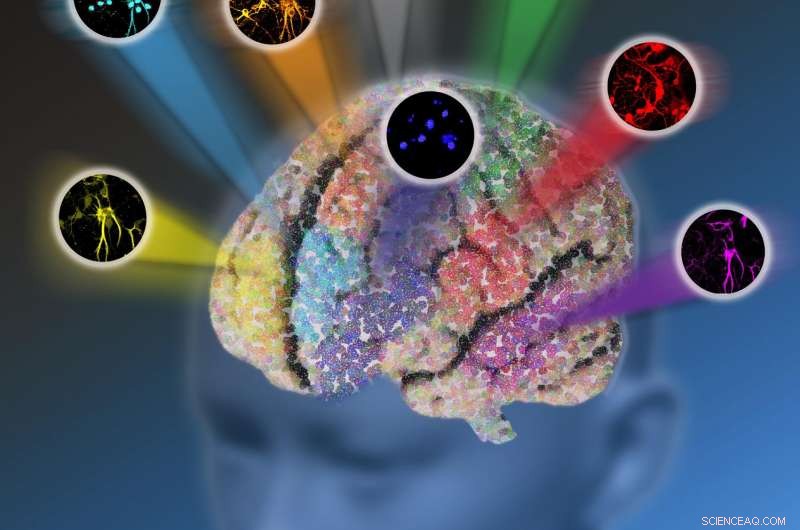
Onderzoekers van Columbia University ontwikkelden een nieuw optisch microscopieplatform, elektronische pre-resonantie gestimuleerde Raman-verstrooiing (epr-SRS) microscopie genaamd, dat een hoge mate van gevoeligheid en selectiviteit combineert. De innovatieve techniek zorgt voor de beeldvorming van maximaal 24 biomoleculaire structuren tegelijk in plaats van beperkt te worden door slechts vijf fluorescerende eiwitten. Krediet:Nicoletta Barolini, Universiteit van Columbia
Onderzoekers van de Columbia University hebben een belangrijke stap gezet in het doorbreken van de zogenaamde "kleurenbarrière" van lichtmicroscopie voor biologische systemen, waardoor een veel uitgebreidere, systeembrede labeling en beeldvorming van een groter aantal biomoleculen in levende cellen en weefsels dan momenteel haalbaar is. De vooruitgang heeft het potentieel voor veel toekomstige toepassingen, inclusief het helpen begeleiden van de ontwikkeling van therapieën voor de behandeling en genezing van ziekten.
In een online gepubliceerde studie op 19 april in Natuur , het team, onder leiding van universitair hoofddocent chemie Wei Min, rapporteert de ontwikkeling van een nieuw optisch microscopieplatform met drastisch verbeterde detectiegevoeligheid. Aanvullend, de studie beschrijft de creatie van nieuwe moleculen die, in combinatie met de nieuwe instrumenten, de gelijktijdige labeling en beeldvorming van maximaal 24 specifieke biomoleculen mogelijk maken, bijna vijf keer het aantal biomoleculen dat met bestaande technologieën tegelijkertijd in beeld kan worden gebracht.
"In het tijdperk van de systeembiologie, hoe tegelijkertijd een groot aantal moleculaire soorten in cellen met een hoge gevoeligheid en specificiteit in beeld te brengen, blijft een grote uitdaging voor optische microscopie, " zei Min. "Wat ons werk nieuw en uniek maakt, is dat er twee synergetische stukken zijn - instrumentatie en moleculen - die samenwerken om dit al lang bestaande obstakel te bestrijden. Ons platform heeft het vermogen om het begrip van complexe biologische systemen te transformeren:de enorme kaart van menselijke cellen, metabole routes, de functies van verschillende structuren in de hersenen, de interne omgeving van tumoren, en macromolecuulassemblage, om er een paar op te noemen."
Alle bestaande methoden om verschillende structuren in levende cellen en weefsels waar te nemen, hebben hun eigen sterke punten, maar ze worden allemaal ook gehinderd door fundamentele beperkingen, niet de minste daarvan is het bestaan van een 'kleurbarrière'.

Onderzoekers van Columbia University ontwikkelden een nieuw optisch microscopieplatform, elektronische pre-resonantie gestimuleerde Raman-verstrooiing (epr-SRS) microscopie genaamd, dat een hoge mate van gevoeligheid en selectiviteit combineert. De innovatieve techniek zorgt voor de beeldvorming van maximaal 24 biomoleculaire structuren tegelijk in plaats van beperkt te worden door slechts vijf fluorescerende eiwitten. Krediet:Nicoletta Barolini, Universiteit van Columbia
Fluorescentiemicroscopie, bijvoorbeeld, is extreem gevoelig en als zodanig, is de meest voorkomende techniek die wordt gebruikt in biologielaboratoria. Met de microscoop kunnen wetenschappers cellulaire processen in levende systemen volgen door eiwitten te gebruiken die algemeen worden aangeduid als "fluorescerende eiwitten" met meestal maximaal vijf kleuren. Elk van de fluorescerende eiwitten heeft een doelstructuur die het een "tag, " of kleur aan. De vijf fluorescerende eiwitten, of kleuren, meestal gebruikt om deze structuren te taggen zijn BFP (Blue Fluorescent Protein), ECFP (cyaan fluorescerend eiwit), GFP (groen fluorescerend eiwit), mVenus (Geel Fluorescerend Eiwit), en DsRed (rood fluorescerend eiwit).
Ondanks zijn sterke punten, fluorescentiemicroscopie wordt belemmerd door de "kleurbarrière, " wat onderzoekers beperkt tot het zien van maximaal vijf structuren tegelijk omdat de gebruikte fluorescerende eiwitten een reeks niet te onderscheiden tinten uitstralen die, als resultaat, vallen in vijf brede kleurcategorieën.
Als een onderzoeker alle honderden structuren en verschillende celtypen in een levend monster van hersentumorweefsel probeert te observeren, bijvoorbeeld, ze zou beperkt zijn tot het zien van maximaal vijf structuren tegelijk op een enkel weefselmonster. Als ze meer dan die vijf wilde zien, ze zou het weefsel moeten reinigen van de fluorescerende labels die ze gebruikte om de laatste vijf structuren te identificeren en te labelen om diezelfde fluorescerende labels te gebruiken om nog een set van maximaal vijf structuren te identificeren. Ze zou dit proces moeten herhalen voor elke set van maximaal vijf structuren die ze wil zien. Het is niet alleen arbeidsintensief om maximaal vijf constructies tegelijk te observeren, maar bij het reinigen van het weefsel, vitale componenten van dat weefsel kunnen verloren gaan of beschadigd raken.
"We willen ze allemaal tegelijkertijd zien om te zien hoe ze alleen werken en ook hoe ze met elkaar omgaan, " zei Lu Wei, hoofdauteur van de studie en een postdoctoraal onderzoeker in het Min-lab. "Er zijn veel componenten in een biologische omgeving en we moeten alles tegelijkertijd kunnen zien om de processen echt te begrijpen."

Onderzoekers van Columbia University ontwikkelden een nieuw optisch microscopieplatform, elektronische pre-resonantie gestimuleerde Raman-verstrooiing (epr-SRS) microscopie genaamd, dat een hoge mate van gevoeligheid en selectiviteit combineert. De innovatieve techniek zorgt voor de beeldvorming van maximaal 24 biomoleculaire structuren tegelijk in plaats van beperkt te worden door slechts vijf fluorescerende eiwitten. Krediet:Nicoletta Barolini, Universiteit van Columbia
Naast fluorescentiemicroscopie, er zijn momenteel verschillende Raman-microscopietechnieken in gebruik voor het observeren van levende cel- en weefselstructuren die werken door de trillingen zichtbaar te maken die voortvloeien uit karakteristieke chemische bindingen in structuren. Traditionele Raman-microscopie produceert de sterk gedefinieerde kleuren die in fluorescentiemicroscopie ontbreken, maar mist de gevoeligheid. Als zodanig, het vereist een sterke, geconcentreerd trillingssignaal dat alleen kan worden bereikt door de aanwezigheid van miljoenen structuren met dezelfde chemische binding. Als het signaal van de chemische bindingen niet sterk genoeg is, het visualiseren van de bijbehorende structuur is bijna onmogelijk.
Om deze uitdaging aan te gaan, Min en zijn team, waaronder profs. Virginia Cornish in scheikunde en Rafael Yuste in neurowetenschappen, streefde naar een nieuwe hybride van bestaande microscopietechnieken.
Ze ontwikkelden een nieuw platform genaamd elektronische pre-resonantie gestimuleerde Raman-verstrooiing (epr-SRS) microscopie dat het beste van twee werelden combineert, een hoge mate van gevoeligheid en selectiviteit samenbrengen. De innovatieve techniek identificeert, met extreme specificiteit, structuren met een aanzienlijk lagere concentratie - in plaats van miljoenen van dezelfde structuur die nodig zijn om de aanwezigheid van die structuur in traditionele Raman-microscopie te identificeren, het nieuwe instrument vereist slechts 30 voor identificatie. De techniek maakt ook gebruik van een nieuwe reeks tagging-moleculen die door het team zijn ontworpen om synergetisch te werken met de ultramoderne technologie. Het versterkte "kleurenpalet" van moleculen verbreedt de tagging-mogelijkheden, waardoor de beeldvorming van maximaal 24 structuren tegelijk mogelijk is in plaats van beperkt te worden door slechts vijf fluorescerende kleuren. De onderzoekers denken dat er in de toekomst nog mogelijkheden zijn voor verdere uitbreiding.
Het team heeft het epr-SRS-platform met succes getest in hersenweefsel. "We konden de verschillende cellen zien samenwerken, "Zei Wei. "Dat is de kracht van een groter kleurenpalet. We kunnen nu al deze verschillende structuren in hersenweefsel tegelijk verlichten. In de toekomst hopen we ze in realtime te kunnen zien functioneren." Hersenweefsel is niet het enige waarvoor de onderzoekers deze techniek voor ogen hebben, voegde ze eraan toe. "Verschillende celtypes hebben verschillende functies, en wetenschappers bestuderen meestal slechts één celtype tegelijk. Met meer kleuren, we kunnen nu beginnen met het gelijktijdig bestuderen van meerdere cellen om te observeren hoe ze op elkaar inwerken en functioneren, zowel alleen als samen in gezonde omstandigheden versus in ziektetoestanden."
Het nieuwe platform heeft veel potentiële toepassingen, Min zei, eraan toevoegend dat het mogelijk is dat de techniek ooit kan worden gebruikt bij de behandeling van tumoren die moeilijk te doden zijn met beschikbare medicijnen. "Als we kunnen zien hoe structuren in kankercellen op elkaar inwerken, we kunnen manieren identificeren om specifieke structuren nauwkeuriger aan te pakken, "zei hij. "Dit platform zou het spel kunnen veranderen in het streven om alles te begrijpen dat veel componenten heeft."
 Kaliumpermanganaat Experimenten
Kaliumpermanganaat Experimenten Hoe maak je absorberende waterkristallen
Hoe maak je absorberende waterkristallen  Wetenschappers maken gefermenteerd sap en functioneel brood om bloedarmoede te behandelen
Wetenschappers maken gefermenteerd sap en functioneel brood om bloedarmoede te behandelen Het creëren van een snellere, on-site manier om bepaalde alkylstoffen te detecteren
Het creëren van een snellere, on-site manier om bepaalde alkylstoffen te detecteren Experimentele tests van relativistische chemie zullen het periodiek systeem bijwerken
Experimentele tests van relativistische chemie zullen het periodiek systeem bijwerken
Hoofdlijnen
- Waarom is een atom elektrisch neutraal?
- Overeenkomsten van mitose en meiose
- Welke cellen kunnen door het menselijk oog worden gezien?
- Mitzi en de gigantische haarbal
- Hoe beïnvloeden Genotype en Fenotype hoe je eruit ziet?
- Biologen maken kever met functioneel extra oog
- Levenscyclus van modder daubers
- CRISPR gebruiken om warmer te maken, minder vette varkens
- Daling van huismus in verband met luchtvervuiling en slechte voeding
- Verschil tussen eenvoudige en samengestelde machines

- Natuurkundigen ontwikkelen theoretisch model voor neurale activiteit van muizenhersenen

- Eerste gebruik van microscopische geluidsgolven om celafwijkingen te bestuderen

- Gigantische verbetering van elektromagnetische golven onthuld in kleine diëlektrische deeltjes
- LiDAR verwerft bereiksignalen met micron-nauwkeurigheid
 10 gedenkwaardige meteoorcrashes
10 gedenkwaardige meteoorcrashes  Hoe het gebied van een gelijkzijdige driehoek te berekenen
Hoe het gebied van een gelijkzijdige driehoek te berekenen  Black Hole-experimenten voor kinderen
Black Hole-experimenten voor kinderen Shoppers zeggen dat Amazon Prime Day-glitch $ 13 heeft verkocht, 000 camera-apparatuur voor $ 94, meer dan 99% korting
Shoppers zeggen dat Amazon Prime Day-glitch $ 13 heeft verkocht, 000 camera-apparatuur voor $ 94, meer dan 99% korting Parasitaire wormen wachten niet om te worden opgeslokt door nieuwe gastheren
Parasitaire wormen wachten niet om te worden opgeslokt door nieuwe gastheren Simulaties tonen aan dat Webb Telescope verre sterrenstelsels kan onthullen die verborgen zijn in quasars schittering
Simulaties tonen aan dat Webb Telescope verre sterrenstelsels kan onthullen die verborgen zijn in quasars schittering Studenten ontdekken verborgen 15e-eeuwse tekst op middeleeuwse manuscripten
Studenten ontdekken verborgen 15e-eeuwse tekst op middeleeuwse manuscripten Leren van de rijkdom van de natuur:nieuwe bibliotheken voor het ontdekken van medicijnen
Leren van de rijkdom van de natuur:nieuwe bibliotheken voor het ontdekken van medicijnen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

