
Wetenschap
Deep learning AI ontdekt verrassende nieuwe antibiotica
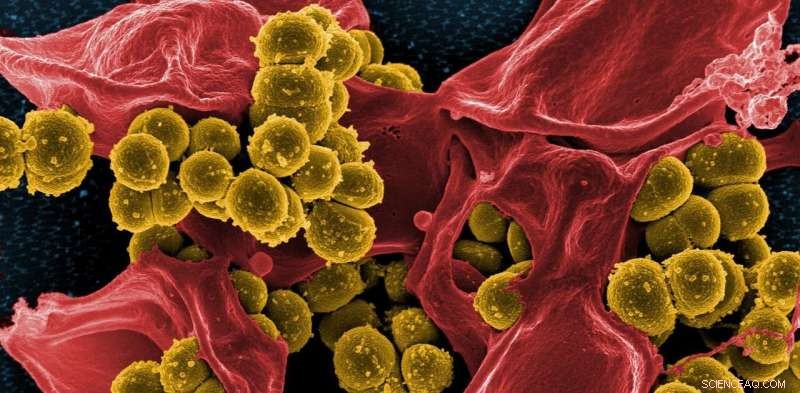
Een gekleurd elektronenmicroscoopbeeld van MRSA. Krediet:NIH - NIAID/flickr, CC BY
Stel je voor dat je een fossielenjager bent. Je brengt maanden door in de hitte van Arizona om botten op te graven om te ontdekken dat wat je hebt ontdekt afkomstig is van een eerder ontdekte dinosaurus.
Dat is hoe de zoektocht naar antibiotica de laatste tijd is verlopen. De relatief weinige antibioticajagers die er zijn, vinden steeds dezelfde soorten antibiotica.
Met de snelle stijging van de resistentie tegen geneesmiddelen bij veel ziekteverwekkers, nieuwe antibiotica zijn hard nodig. Het kan slechts een kwestie van tijd zijn voordat een wond of kras levensbedreigend wordt. Toch zijn er de laatste tijd weinig nieuwe antibiotica op de markt gekomen, en zelfs dit zijn slechts kleine varianten van oude antibiotica.
Hoewel de vooruitzichten somber lijken, de recente revolutie in kunstmatige intelligentie (AI) biedt nieuwe hoop. In een studie gepubliceerd op 20 februari in het tijdschrift Cel , wetenschappers van MIT en Harvard gebruikten een soort AI genaamd deep learning om nieuwe antibiotica te ontdekken.
De traditionele manier om antibiotica te ontdekken - uit bodem- of plantenextracten - heeft geen nieuwe kandidaten opgeleverd, en er zijn veel sociale en economische hindernissen om dit probleem op te lossen, ook. Sommige wetenschappers hebben onlangs geprobeerd het aan te pakken door in het DNA van bacteriën te zoeken naar nieuwe antibiotica-producerende genen. Anderen zoeken antibiotica op exotische locaties zoals in onze neuzen.
Geneesmiddelen die via dergelijke onconventionele methoden worden gevonden, staan voor een rotsachtige weg om op de markt te komen. De medicijnen die effectief zijn in een petrischaal, werken mogelijk niet goed in het lichaam. Ze worden mogelijk niet goed geabsorbeerd of kunnen bijwerkingen hebben. Het produceren van deze medicijnen in grote hoeveelheden is ook een grote uitdaging.
Diep leren
Voer diep leren in. Deze algoritmen sturen veel van de huidige gezichtsherkenningssystemen en zelfrijdende auto's aan. Ze bootsen na hoe neuronen in onze hersenen werken door patronen in gegevens te leren. Een individueel kunstmatig neuron, zoals een minisensor, kan eenvoudige patronen zoals lijnen of cirkels detecteren. Door duizenden van deze kunstmatige neuronen te gebruiken, deep learning AI kan uiterst complexe taken uitvoeren, zoals het herkennen van katten in video's of het detecteren van tumoren in biopsiebeelden.
Gezien zijn kracht en succes, het is misschien niet verrassend om te horen dat onderzoekers die op zoek zijn naar nieuwe medicijnen, deep learning AI omarmen. Toch is het bouwen van een AI-methode voor het ontdekken van nieuwe medicijnen geen triviale taak. Voor een groot deel, dit komt omdat er op het gebied van AI geen gratis lunch is.
De No Free Lunch-stelling stelt dat er geen universeel superieur algoritme is. Dit betekent dat als een algoritme spectaculair presteert in één taak, zeg gezichtsherkenning, dan zal het spectaculair falen in een andere taak, zoals het ontdekken van medicijnen. Daarom kunnen onderzoekers niet zomaar gebruik maken van kant-en-klare deep learning AI.
Het Harvard-MIT-team gebruikte een nieuw type deep learning AI, grafneurale netwerken genaamd, voor het ontdekken van medicijnen. Terug in het AI-stenen tijdperk van 2010, AI-modellen voor het ontdekken van medicijnen werden gebouwd met behulp van tekstbeschrijvingen van chemicaliën. Dit is hetzelfde als iemands gezicht beschrijven met woorden als 'donkere ogen' en 'lange neus'. Deze tekstbeschrijvingen zijn nuttig, maar geven duidelijk niet het hele plaatje weer. De AI-methode die wordt gebruikt door het Harvard-MIT-team beschrijft chemicaliën als een netwerk van atomen, wat het algoritme een completer beeld van de chemische stof geeft dan tekstbeschrijvingen kunnen bieden.
Menselijke kennis en AI onbeschreven blad
Maar deep learning alleen is niet voldoende om nieuwe antibiotica te ontdekken. Het moet gepaard gaan met diepgaande biologische kennis van infecties.
Het Harvard-MIT-team heeft het AI-algoritme minutieus getraind met voorbeelden van medicijnen die wel en niet effectief zijn. In aanvulling, ze gebruikten medicijnen waarvan bekend is dat ze veilig zijn bij mensen om de AI te trainen. Vervolgens gebruikten ze het AI-algoritme om potentieel veilige maar krachtige antibiotica te identificeren uit miljoenen chemicaliën.
In tegenstelling tot mensen, AI heeft geen vooroordelen, vooral over hoe een antibioticum eruit zou moeten zien. Met behulp van ouderwetse AI, mijn lab ontdekte onlangs enkele verrassende kandidaten voor de behandeling van tuberculose, waaronder een antipsychoticum. In de studie van het Harvard-MIT-team, ze vonden een goudmijn van nieuwe kandidaten. Deze kandidaat-geneesmiddelen lijken in niets op bestaande antibiotica. Een veelbelovende kandidaat is Halicin, een geneesmiddel dat wordt onderzocht voor de behandeling van diabetes.
Halicine, verrassend genoeg, was niet alleen krachtig tegen E coli , de bacteriën waarop het AI-algoritme is getraind, maar ook op meer dodelijke ziekteverwekkers, inclusief die welke tuberculose en darmontsteking veroorzaken. Opmerkelijk, Halicine was krachtig tegen geneesmiddelresistent Acinetobacter baumanni . Deze bacterie staat bovenaan de lijst van meest dodelijke ziekteverwekkers die is samengesteld door de Centers for Disease Control and Prevention.
Helaas, De brede potentie van Halicine suggereert dat het ook onschadelijke bacteriën in ons lichaam kan vernietigen. Het kan ook metabolische bijwerkingen hebben, omdat het oorspronkelijk bedoeld was als een middel tegen diabetes. Gezien de grote behoefte aan nieuwe antibiotica, dit kunnen kleine offers zijn om te betalen om levens te redden.
De evolutie voorblijven
Gezien de belofte van Halicin, moeten we de zoektocht naar nieuwe antibiotica stoppen?
Halicin kan alle hindernissen wegnemen en uiteindelijk de markt bereiken. Maar het moet nog steeds een niet aflatende vijand overwinnen die de belangrijkste oorzaak is van de medicijnresistentiecrisis:evolutie. Mensen hebben de afgelopen eeuw talloze medicijnen naar ziekteverwekkers gegooid. Toch hebben ziekteverwekkers altijd resistentie ontwikkeld. Dus het zal waarschijnlijk niet lang duren voordat we een Halicine-resistente infectie tegenkomen. Hoe dan ook, met de kracht van deep learning AI, we zijn nu misschien beter geschikt om snel te reageren met een nieuw antibioticum.
Er liggen veel uitdagingen in het verschiet voor potentiële antibiotica die worden ontdekt met behulp van AI om de kliniek te bereiken. De omstandigheden waarin deze medicijnen worden getest, verschillen van die in het menselijk lichaam. Mijn lab en anderen bouwen nieuwe AI-tools om de interne omgeving van het lichaam te simuleren om de potentie van antibiotica te beoordelen. AI-modellen kunnen nu ook de toxiciteit en bijwerkingen van geneesmiddelen voorspellen. Deze AI-technologieën samen kunnen ons binnenkort een voorsprong geven in de nooit eindigende strijd tegen medicijnresistentie.
Dit artikel is opnieuw gepubliceerd vanuit The Conversation onder een Creative Commons-licentie. Lees het originele artikel. 
 Elektriciteit gebruiken om verontreinigende stoffen die overblijven na afvalwaterzuivering af te breken
Elektriciteit gebruiken om verontreinigende stoffen die overblijven na afvalwaterzuivering af te breken Corrosieweerstand van roestvrij staal tot zwavelzuur
Corrosieweerstand van roestvrij staal tot zwavelzuur MXene-materialen helpen fotodetectoren het licht te zien
MXene-materialen helpen fotodetectoren het licht te zien Wetenschappers onthullen potentiële afhankelijkheid van elektroreductie van stikstofmonoxide tot ammoniak
Wetenschappers onthullen potentiële afhankelijkheid van elektroreductie van stikstofmonoxide tot ammoniak Om ingenieurs te verrassen, straling kan corrosie van sommige materialen vertragen
Om ingenieurs te verrassen, straling kan corrosie van sommige materialen vertragen
 Bescherming van koraalriffen in een verslechterende omgeving
Bescherming van koraalriffen in een verslechterende omgeving Nieuwe kijk op hoe oceaanpompen de klimaatverandering beïnvloeden
Nieuwe kijk op hoe oceaanpompen de klimaatverandering beïnvloeden Wetenschappers onthullen cumulatieve langetermijneffecten van frequente groene getijden in kustoceanen
Wetenschappers onthullen cumulatieve langetermijneffecten van frequente groene getijden in kustoceanen Insecten houden van windworpen
Insecten houden van windworpen Hout stoken in stadsverwarmingsinstallaties heeft geleid tot klimaatbesparing
Hout stoken in stadsverwarmingsinstallaties heeft geleid tot klimaatbesparing
Hoofdlijnen
- De hoogste partiële zuurstofdruk in de bloedsomloop
- Waarom is een atom elektrisch neutraal?
- Stappen van DNA Transcriptie
- Studie onthult verschillen in belangrijke evoluties van het genoom van gewassen
- Wat zijn de functies van glazen schuif- en afdekglaasjes?
- Wat zijn de 10 Major Body Systems?
- Droogte geen dingo's achter het uitsterven van tijgers op het vasteland van Australië:studie
- Eukaryotische celkarakteristieken
- Feiten over osmose voor kinderen
- Botten, goed of slecht, domineren Twitter-gesprek:studie

- Rapport zegt dat werknemers de grootste bedreiging voor gegevensbeveiliging zijn

- Impact van blockbuster antitrustonderzoek gaat verder dan AT&T, Tijdwaarschuwing

- Casanova:een schaalbaar consensusprotocol voor blockchain

- GM besteedt $ 3,5 miljard in Michigan onder herziene belastingkredietovereenkomst

 Vergelijking voor glucosemetabolisme
Vergelijking voor glucosemetabolisme Politicoloog beschrijft de opkomst van negatieve partijdigheid en hoe het kiezers drijft
Politicoloog beschrijft de opkomst van negatieve partijdigheid en hoe het kiezers drijft Wetenschappers ontdekken mechanismen achter thermo-elektrisch materiaal
Wetenschappers ontdekken mechanismen achter thermo-elektrisch materiaal 'S Werelds eerste 3D-simulaties van superlichtgevende supernova's
'S Werelds eerste 3D-simulaties van superlichtgevende supernova's Stadsbomen blijken de mentale en algemene gezondheid te verbeteren
Stadsbomen blijken de mentale en algemene gezondheid te verbeteren 15 meter lang skelet van uitgestorven dolfijn suggereert parallelle evolutie onder walvissen
15 meter lang skelet van uitgestorven dolfijn suggereert parallelle evolutie onder walvissen De helling van een tangens berekenen
De helling van een tangens berekenen Chuck Yeager, 1e die de geluidsbarrière doorbreekt, sterft op 97
Chuck Yeager, 1e die de geluidsbarrière doorbreekt, sterft op 97
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

