
Wetenschap
Water is een polair molecuul omdat?
* ongelijke delen van elektronen: Het zuurstofatoom in water is meer elektronegatief dan de waterstofatomen. Dit betekent dat het de gedeelde elektronen in de covalente bindingen sterker aantrekt, wat resulteert in een gedeeltelijke negatieve lading (Δ-) op het zuurstofatoom en gedeeltelijke positieve ladingen (Δ+) op de waterstofatomen.
* gebogen moleculaire vorm: De twee waterstofatomen en het zuurstofatoom in water vormen een gebogen vorm (vergelijkbaar met A V). Deze vorm, met het zuurstofatoom aan de top, verbetert de scheiding van ladingen verder.
Over het algemeen creëert de ongelijke delen van elektronen en de gebogen vorm van het watermolecuul een permanent dipoolmoment, waardoor water een polair molecuul is. Deze polariteit is verantwoordelijk voor veel van de unieke eigenschappen van water, waaronder het vermogen om veel stoffen op te lossen, waterstofbindingen te vormen en te fungeren als een oplosmiddel voor biologische reacties.
Hoofdlijnen
- Welk orgaan is boonvormig en verantwoordelijk voor de opslag van rode bloedcellen?
- Wat is de waterige omgeving waar DNA en ribosomen binnen drijven?
- Welke suikers worden door mensen verteerd?
- Wat treedt cellulaire ademhaling voor in aanwezigheid van?
- Voert gist levensprocessen uit?
- Waarom vogels over grote afstanden migreren en hoe u kunt helpen tijdens hun broedseizoen
- Wie zijn de verschillende biologen en hun bijdragen aan de ontwikkeling van de biologische biotechnologie?
- Wat is de route die door mucine door cel is genomen door de synthese van de secretie om alle betrokken organellen en processen te vermelden?
- Wat is mRNA, rRNA en tRNA?
- Eindelijk een cruciaal enzym onthuld
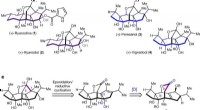
- Chemici synthetiseren voor het eerst perseanol
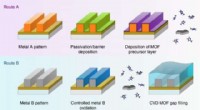
- Nieuwe isolatietechniek maakt de weg vrij voor krachtigere en kleinere spanen
- Onderzoekers ontwikkelen een manier om corrosie door ruwe olie beter te voorspellen

- Kleine implantaten voor cellen zijn functioneel in vivo
 Hoeveel atomen zijn er in 2 mol waterstof?
Hoeveel atomen zijn er in 2 mol waterstof?  Hoe gemuteerde zebravissen hielpen het geheim van hun strepen te ontsluiten
Hoe gemuteerde zebravissen hielpen het geheim van hun strepen te ontsluiten  Welk percentage zuurstof heeft CH4O?
Welk percentage zuurstof heeft CH4O?  Wat is uitwisselbare zuurgraad?
Wat is uitwisselbare zuurgraad?  Hoeveel mol waterstof is er nodig om 36 gram water te maken?
Hoeveel mol waterstof is er nodig om 36 gram water te maken?  Sumatraanse neushoorns zijn nooit hersteld van verliezen tijdens het Pleistoceen, genoom bewijs toont
Sumatraanse neushoorns zijn nooit hersteld van verliezen tijdens het Pleistoceen, genoom bewijs toont Zien we de zon in het verleden als we naar de hemel kijken?
Zien we de zon in het verleden als we naar de hemel kijken?  Welk vasculair weefsel draagt voedsel van de bladeren tot wortels?
Welk vasculair weefsel draagt voedsel van de bladeren tot wortels?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com


