
Wetenschap
Eindelijk een cruciaal enzym onthuld
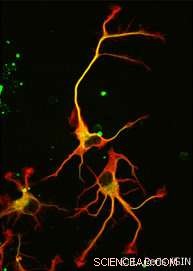
Krediet:CEA
Na 40 jaar onderzoek, onderzoekers van het CEA, CNRS, Universiteit Grenoble-Alpen, Universiteit van Montpellier en Inserm hebben eindelijk het enzym geïdentificeerd dat verantwoordelijk is voor de detyrosinatie van tubuline. Verrassend genoeg, het is niet één enzym maar twee die de modificatie van deze essentiële component van de cytoskeletstructuur regelen. Dit werk opent nieuwe perspectieven voor een beter begrip van de rol van tubuline, waarvan de deregulering in verband is gebracht met kanker, hart- en vaatziekten en neurale aandoeningen.
Een internationaal samenwerkingsproject waarbij onderzoekers van CEA (Franse Commissie voor Atoomenergie), CNRS (Frans Nationaal Centrum voor Wetenschappelijk Onderzoek), Inserm (Frans Nationaal Instituut voor Gezondheid en Medisch Onderzoek), Universiteit Grenoble-Alpen, Universiteit van Montpellier en Stanford University hebben het enzym geïdentificeerd, Tubuline CarboxyPeptidase (TCP), verantwoordelijk voor de biochemische transformatie van cellulaire microtubuli, door middel van detyrosinatie. Detyrosinering is een biologische reactie die resulteert in de verwijdering van het terminale aminozuur tyrosine uit α-tubuline, een van de subeenheden die microtubuli vormen. Na vier decennia van onderzoek, biologen zijn er eindelijk in geslaagd dit eiwit te zuiveren, en zijn doorgegaan met het leveren van bewijs van zijn cellulaire activiteit.
Microtubuli dragen bij aan essentiële cellulaire functies
Microtubuli zijn dynamische vezels die in alle cellen aanwezig zijn, ze worden gevormd door de combinatie van twee eiwitten (α-tubuline en β-tubuline). Microtubuli vervullen tal van functies:ze scheiden de chromosomen om ze tijdens de celdeling tussen de twee dochtercellen te verdelen; ze dragen bij aan cellulaire polariteit, morfologie en celmigratie; ze vormen ook een netwerk in de cel, op welke cellulaire bestanddelen, zoals eiwitten of RNA-strengen, kan worden vervoerd.
Deze cellulaire functies worden gereguleerd door "signalen" die aanwezig zijn op het oppervlak van microtubuli. Deze signalen, bestaande uit biochemische modificaties van aminozuren (bekend als post-translationele modificaties, zoals ze plaatsvinden na de eiwitsynthese), komen voor op meerdere plaatsen in cellen en worden uitgevoerd door een breed scala aan enzymen; in dit geval, de enzymen modificeren de tubulines.
Het enzym TCP, eindelijk geïdentificeerd na 40 jaar mysterie
De activiteit van een van deze enzymen werd in 1977 voor het eerst vastgesteld door een Argentijns onderzoeksteam. Ze noemden deze activiteit "TCP" (Tubulin CarboxyPeptidase). Dit enzym bleek de detyrosineringsreactie uit te voeren:verwijdering van het terminale aminozuur, een tyrosine, vanaf het einde van α-tubuline, maar het eiwit zelf moest nog worden geïdentificeerd (de grootte en sequentie waren onbekend). Een ander enzym, de ligase-TTL, voert de omgekeerde reactie uit - tyrosinering - waardoor de tyrosine wordt vervangen. De detyrosinerings-/tyrosineringscyclus is van vitaal belang voor de cel en het organisme als geheel. Massale (abnormale) detyrosinatie wordt waargenomen bij een aantal ernstige kankersoorten en bij hart- en vaatziekten.
De identificatie en karakterisering van TCP was daarom een belangrijke doelstelling voor onderzoekers die de fysiologische functie van α-tubuline-detyrosinatie wilden begrijpen en de gevolgen van de remming ervan wilden bepalen.
Om TCP te isoleren, de onderzoekers volgden zijn activiteit, gebruikte conventionele biochemische technieken, en werkte samen met chemici van Stanford University, die een klein molecuul ontwikkelde dat zijn activiteit remde. Dit molecuul werd vervolgens gebruikt als lokaas om het ongrijpbare enzym te "vangen".
Uiteindelijk, niet een, maar er werden twee enzymen ontdekt. VASH1 en VASH2 waren al bekend bij wetenschappers, maar ze waren niet eerder in verband gebracht met het cytoskelet. De onderzoekers toonden aan dat, wanneer geassocieerd met een partnereiwit genaamd SVBP, VASH1 en VASH2 kunnen detyrosinatie van α-tubuline veroorzaken. Om deze activiteit te demonstreren, het team remde de expressie van VASH1/2 (of hun partner SVBP) in neuronen. In beide gevallen, een zeer sterke afname van het niveau van detyrosinatie van α-tubuline werd waargenomen samen met veranderde neuronale morfologie (zie figuur). De onderzoekers toonden verder aan dat deze enzymen ook betrokken zijn bij de ontwikkeling van de hersenschors.
Dus, 40 jaar nadat het eerste bewijs van α-tubuline detyrosinatie werd gepresenteerd, de verantwoordelijke enzymen zijn geïdentificeerd. Wetenschappers hopen nu dat door de TCP-activiteit te moduleren en hun kennis van de detyrosinerings-/tyrosineringscyclus te verbeteren, ze zullen nieuwe behandelingen kunnen ontwikkelen voor specifieke kankers, en om een beter begrip te krijgen van de hersen- en hartfuncties.
 Levenscyclus van de Leeuw
Levenscyclus van de Leeuw  NASA vangt kortstondige tropische storm Amanda
NASA vangt kortstondige tropische storm Amanda Vijftig simulaties van de Really Big One laten zien hoe een aardbeving van 9.0 Cascadia zou kunnen verlopen
Vijftig simulaties van de Really Big One laten zien hoe een aardbeving van 9.0 Cascadia zou kunnen verlopen Wat drijft mensen om de planeet te redden? Verhalen of feiten?
Wat drijft mensen om de planeet te redden? Verhalen of feiten? Zeedieren volgen al miljoenen jaren hun favoriete klimaat
Zeedieren volgen al miljoenen jaren hun favoriete klimaat
Hoofdlijnen
- Wat zijn purines en pyrimidines?
- Neteldieren controleren bacteriën op afstand
- Slimme app gebruikt smartphonecamera om plantensoorten te identificeren
- Het mysterie,
- De levenscyclus van Gymnosperms
- Voelen mannen en vrouwen pijn anders?
- Vergelijking & identificatie van kikkers en menselijke bloedcellen
- Vergeten is niet altijd slecht - het helpt ons betere beslissingen te nemen
- Een nieuwe strategie die door Helicobacter pylori wordt gebruikt om mitochondriën aan te pakken
- Afgedankt afval kan een schat aan zeldzame metalen zijn

- Op weg naar autonome materialen, onderzoekers ontwerpen patronen in zelfrijdende vloeibare kristallen

- Na meer dan een decennium, ChIP-seq kan toch kwantitatief zijn
- Chemicaliën die malaria genezen, kunnen ook onkruid doden

- Nieuwe 3D-printtechniek voor biomaterialen
 Nieuw inzicht in hoe Giants Causeway en Devils Postpile werden gevormd
Nieuw inzicht in hoe Giants Causeway en Devils Postpile werden gevormd Wetenschappers ontrafelen het effect van ENSO en Atlantische multidecadale oscillatie op de Oost-Aziatische wintermoesson
Wetenschappers ontrafelen het effect van ENSO en Atlantische multidecadale oscillatie op de Oost-Aziatische wintermoesson Vuile was in de ruimte? nasa, Getijden aanpakken schoonmaak uitdaging
Vuile was in de ruimte? nasa, Getijden aanpakken schoonmaak uitdaging Hoe Factorise in Math
Hoe Factorise in Math  Hoe David wint van Goliath in de gevestigde industrie
Hoe David wint van Goliath in de gevestigde industrie Nieuwe inzichten in de structuur van een killer-eiwit
Nieuwe inzichten in de structuur van een killer-eiwit Twitter, Pinterest pakt verkeerde informatie van kiezers aan
Twitter, Pinterest pakt verkeerde informatie van kiezers aan Concentrische ringen gevonden in de puinschijf van een jonge nabije ster
Concentrische ringen gevonden in de puinschijf van een jonge nabije ster
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

