
Wetenschap
Wat gebeurt er met een stof tijdens veranderingen tussen vaste stof en gas?
vast tot gas (sublimatie):
* Energieabsorptie: De vaste stof absorbeert energie, meestal in de vorm van warmte.
* Verhoogde moleculaire beweging: De energie zorgt ervoor dat de moleculen binnen de vaste stof sneller trillen.
* Breek intermoleculaire krachten: De verhoogde trilling verzwakt de krachten die de moleculen in een vaste, rigide structuur houden.
* Directe overgang: De moleculen krijgen voldoende energie om deze krachten volledig te overwinnen en te ontsnappen in de gasvormige fase zonder een vloeibare toestand te passeren.
Gas tot vaste (afzetting):
* Energie -release: Het gas laat energie vrij, meestal als warmte.
* Verminderde moleculaire beweging: De moleculen vertragen en verliezen kinetische energie.
* Vorming van intermoleculaire krachten: Naarmate de moleculen vertragen, kunnen ze aantrekkelijke krachten met elkaar vormen.
* Directe overgang: De moleculen verliezen voldoende energie om een rigide structuur te vormen, die rechtstreeks overstappen van gas naar vaste stof.
Sleutelpunten:
* Faseveranderingen: De sleutel is dat deze veranderingen een verschuiving in de toestand van materie inhouden, maar geen verandering in de chemische samenstelling van de stof.
* Energy Exchange: Energie wordt tijdens deze transformaties geabsorbeerd (vast tot gas) of vrijgegeven (gas tot vast).
* Moleculaire opstelling: De opstelling van moleculen verandert dramatisch tussen vaste stoffen, vloeistoffen en gassen.
Voorbeelden:
* sublimatie: Droog ijs (vaste CO2) sublimeert rechtstreeks in CO2 -gas.
* afzetting: Vorst vormt zich op koude oppervlakken wanneer waterdamp in de luchtafzettingen rechtstreeks op hen als ijs afzet.
 Onderzoekers identificeren post-translationele vorming van gespannen cyclofanen in bacteriën
Onderzoekers identificeren post-translationele vorming van gespannen cyclofanen in bacteriën Wat is de thermische ontledingsvergelijking voor ammoniumchloride?
Wat is de thermische ontledingsvergelijking voor ammoniumchloride?  Bevriest water om een ijschemische verandering te vormen?
Bevriest water om een ijschemische verandering te vormen?  Moleculen van het leven worden ook wel organische moleculen genoemd omdat?
Moleculen van het leven worden ook wel organische moleculen genoemd omdat?  Welke deeltjes verandert de naam van het atoom?
Welke deeltjes verandert de naam van het atoom?
 Hoe planten kunnen helpen bij het opruimen van residubekkens van oliezanden
Hoe planten kunnen helpen bij het opruimen van residubekkens van oliezanden Onderzoekers berekenen bodembevriezingsdiepte uit satellietgegevens
Onderzoekers berekenen bodembevriezingsdiepte uit satellietgegevens Heeft de pest de neolithische boeren 5200 jaar geleden echt gedecimeerd, zoals een nieuwe studie suggereert?
Heeft de pest de neolithische boeren 5200 jaar geleden echt gedecimeerd, zoals een nieuwe studie suggereert?  Effecten van de mens op zoetwaterecosystemen
Effecten van de mens op zoetwaterecosystemen Feiten over Buzzards
Feiten over Buzzards
Hoofdlijnen
- Wat is de belangrijkste primaire producent in het mariene ecosysteem?
- Wat heeft een blad nodig om voedsel voor de plant te maken?
- Review onderzoekt hoe de antidiabetische eigenschappen van paarse groenten en knollen kunnen worden verbeterd
- Welk deel van het chromosoom is spindelapparaten bevestigd?
- Waarom zou een wetenschapper een analogie in rapport kunnen gebruiken?
- Wat zijn dunne Hread -achtige structuren gevonden in het cytoplasma van een cel?
- Wat zijn steriele en onsteriele objecten?
- Wat is een groep cellen die een gespecialiseerde functie uitvoeren, is een?
- Waarom hebben dieren planten nodig en waarom dieren?
- Een sleutel tot calciumsignalering:structuur van de menselijke IP3R type 3 in zijn ligandvrije toestand

- Minder vocht in natuurlijke vezels

- Synthetische koolhydraten weren pneumokokkeninfecties af

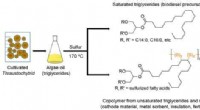
- Eenvoudige methode om hoogwaardige bioactieve stoffen te extraheren uit eencellige algenolie
- Koud weken verlaagt het risico op salmonellagroei op gekiemd voedsel

 Waarom is er een massa-luminositeitsrelatie in sterren?
Waarom is er een massa-luminositeitsrelatie in sterren?  Wetenschappers presenteren een nieuwe methode om elk eiwit in elk soort cel direct en snel te vernietigen
Wetenschappers presenteren een nieuwe methode om elk eiwit in elk soort cel direct en snel te vernietigen De wereldwijde impact van krimpende gletsjers op ongewervelde rivieren in kaart brengen
De wereldwijde impact van krimpende gletsjers op ongewervelde rivieren in kaart brengen Vanuatu geeft wegwerpluiers de spoeling
Vanuatu geeft wegwerpluiers de spoeling Beoordeling van het financiële verliespotentieel van orkaan Harvey
Beoordeling van het financiële verliespotentieel van orkaan Harvey Maak een lijst van de planetenafstanden van de zon?
Maak een lijst van de planetenafstanden van de zon?  Biljarten met een laserstraal
Biljarten met een laserstraal Perfecte randen creëren in 2D-materialen
Perfecte randen creëren in 2D-materialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

