
Wetenschap
Wat is het verschil tussen deeltjes in een vaste en gas?
vaste stoffen
* arrangement: Deeltjes zijn strak verpakt in een normaal, herhaaldelijk patroon (kristallijne structuur) of in een meer willekeurige, minder georganiseerde structuur (amorf).
* Beweging: Deeltjes trillen in vaste posities. Ze hebben lage kinetische energie.
* afstand: Deeltjes zijn heel dicht bij elkaar met weinig ruimte ertussen.
* Dichtheid: Vaste stoffen zijn dicht vanwege de nauwe verpakking van deeltjes.
* Vorm: Vaste stoffen hebben een duidelijke vorm en volume. Ze weerstaan veranderingen in vorm en volume.
gassen
* arrangement: Deeltjes zijn ver uit elkaar verspreid en hebben geen vaste opstelling.
* Beweging: Deeltjes bewegen snel en willekeurig in alle richtingen. Ze hebben hoge kinetische energie.
* afstand: Deeltjes liggen ver uit elkaar met grote ruimtes ertussen.
* Dichtheid: Gassen zijn minder dicht dan vaste stoffen vanwege de grote afstand tussen deeltjes.
* Vorm: Gassen hebben geen duidelijke vorm of volume. Ze nemen de vorm en het volume van hun container aan.
Hier is een analogie:
Stel je een groep mensen voor tijdens een druk concert. Ze zijn dicht bij elkaar en bewegen een beetje, maar blijven meestal op zijn plaats. Dat is als een solide.
Stel je nu voor diezelfde mensen in een groot, leeg veld. Ze kunnen vrij in elke richting bewegen en er is veel ruimte tussen hen. Dat is als een gas.
Key Takeaway: Het belangrijkste verschil tussen vaste stoffen en gassen ligt in de afstand en beweging van hun deeltjes. Dit heeft direct invloed op hun dichtheid, vorm en volume.
 Wat is het meest voorkomende natuurlijke zuur op het oppervlak?
Wat is het meest voorkomende natuurlijke zuur op het oppervlak?  Waarom is het morsen van vloeibare zuurstof bij asfaltbestrating potentieel gevaarlijk?
Waarom is het morsen van vloeibare zuurstof bij asfaltbestrating potentieel gevaarlijk?  Als een klompje ijzerpyriet en goud elk een massa van 50 g hebben, wat kun je dan concluderen over het volumeklompje?
Als een klompje ijzerpyriet en goud elk een massa van 50 g hebben, wat kun je dan concluderen over het volumeklompje?  Is de dichtheid hoger of lager wanneer deeltjes dichterbij zijn in een stof?
Is de dichtheid hoger of lager wanneer deeltjes dichterbij zijn in een stof?  Wat voor soort reactie gebeurt er met zoutzuur en Alka Seltzer?
Wat voor soort reactie gebeurt er met zoutzuur en Alka Seltzer?
 Naar huis bellen? Ily vindt de vaste lijn opnieuw slimmer en gebruiksvriendelijker
Naar huis bellen? Ily vindt de vaste lijn opnieuw slimmer en gebruiksvriendelijker  De Arabische plaat houdt stand
De Arabische plaat houdt stand Zouden de veengebieden van Congo een koolstofbom kunnen zijn?
Zouden de veengebieden van Congo een koolstofbom kunnen zijn? Onderwijs beïnvloedt de religiositeit van Amerikanen – maar niet hoe je zou denken
Onderwijs beïnvloedt de religiositeit van Amerikanen – maar niet hoe je zou denken  Hoe beïnvloedt concurrentie met andere planten de groei van planten?
Hoe beïnvloedt concurrentie met andere planten de groei van planten?
Hoofdlijnen
- Jaws:Hoe een Afrikaanse vis met roggenvin ons helpt de fundamenten van de evolutie te heroverwegen
- Een schimmel die kleiner wordt om de hersenen beter te infecteren
- Wat betekent co-dominantie in genetica?
- Hoe cellen blijven groeien, zelfs als ze worden aangevallen
- Waarom is de kern belangrijk voor een levende cel?
- Wat zijn twee manieren waarop organismen verbonden zijn met de niet -levende omgeving?
- Wat doen de zeven levensprocessen?
- Wat is de betekenis van cellen?
- Bepalen genen al uw geërfde eigenschappen?
- Chemicus stelt nieuwe manier voor om de brandstofkwaliteit te verbeteren met behulp van microgolfstraling
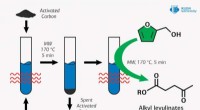
- Menselijke gevaren belemmeren onderzoek naar gif van vampiervleermuizen

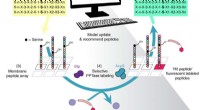
- Machine learning gebruiken om peptiden te ontwerpen
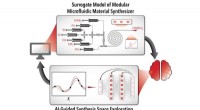
- Virtueel lab vindt de juiste AI-tool voor elk scheikundeprobleem
- Wetenschappers vinden schadelijke chemicaliën in huishoudstof

 Wanneer een chlooratoom in contact komt met lithium, combineren ze om samenstelling te vormen?
Wanneer een chlooratoom in contact komt met lithium, combineren ze om samenstelling te vormen?  Wat geeft de temperatuur aan?
Wat geeft de temperatuur aan?  Hoe steden in het Westen water hebben te midden van droogte
Hoe steden in het Westen water hebben te midden van droogte  Hoe ziet de zon eruit van Jupiter in vergelijking met hoe hij er de aarde uitziet?
Hoe ziet de zon eruit van Jupiter in vergelijking met hoe hij er de aarde uitziet?  Waarom is zeewater zout?
Waarom is zeewater zout?  Welke planeten draaien rond de zon?
Welke planeten draaien rond de zon?  Wanneer werpt de zon de langste schaduwen?
Wanneer werpt de zon de langste schaduwen?  Onderzoekers onthullen patronen van seksueel misbruik in religieuze omgevingen
Onderzoekers onthullen patronen van seksueel misbruik in religieuze omgevingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

