
Wetenschap
Waarom hebben vloeistoffen en gassen geen moduli?
* modulus: Een modulus is een maat voor de stijfheid of weerstand van een materiaal tegen vervorming. Het beschrijft hoeveel stress nodig is om een bepaalde hoeveelheid spanning te veroorzaken.
* vaste stoffen: Vaste stoffen hebben een gedefinieerde kristalstructuur met sterke intermoleculaire krachten die de moleculen op hun plaats houden. Wanneer een kracht wordt uitgeoefend, verzetten deze bindingen zich tegen de vervorming, wat resulteert in een specifieke modulus.
* vloeistoffen: Vloeistoffen hebben zwakkere intermoleculaire krachten dan vaste stoffen. Hun moleculen kunnen bewegen, hoewel ze nog steeds relatief dicht bij elkaar zijn. Wanneer een kracht wordt uitgeoefend, glijden de moleculen langs elkaar heen, wat resulteert in een stroom in plaats van een vaste vervorming. Deze vloeibaarheid betekent dat ze geen gedefinieerde modulus hebben. Ze hebben echter een eigenschap genaamd Viscosity, die hun weerstand tegen stroming meet.
* gassen: Gassen hebben extreem zwakke intermoleculaire krachten en hun moleculen liggen ver uit elkaar. Ze bewegen vrij en gemakkelijk comprimeren. Het aanbrengen van een kracht zal het volume van het gas veranderen in plaats van een gedefinieerde vervorming te veroorzaken, zodat ze geen modulus hebben.
Samenvattend: Het ontbreken van een vaste structuur in vloeistoffen en gassen betekent dat ze de vervorming op een voorspelbare manier zoals vaste stoffen niet kunnen weerstaan, vandaar dat ze geen duidelijke modulus hebben.
Het is belangrijk op te merken dat zelfs vloeistoffen en gassen elastisch gedrag kunnen vertonen onder bepaalde omstandigheden, zoals zeer snelle veranderingen in druk. Dit gedrag is echter vaak van voorbijgaande aard en geen bepalend kenmerk van deze toestanden van materie.
 Upgraden van afvalwaterzuivering resulteert in een aanzienlijke vermindering van intersekse vissen
Upgraden van afvalwaterzuivering resulteert in een aanzienlijke vermindering van intersekse vissen NASA-NOAA-satelliet vindt tropische cycloon Gelena geschoren
NASA-NOAA-satelliet vindt tropische cycloon Gelena geschoren Nieuw onderzoek onthult dat anaërobe vergisting de Britse netto-nul-emissies zou kunnen ondermijnen
Nieuw onderzoek onthult dat anaërobe vergisting de Britse netto-nul-emissies zou kunnen ondermijnen Catastrofale branden vormen al eeuwenlang steden - Grenfell Tower is geen uitzondering
Catastrofale branden vormen al eeuwenlang steden - Grenfell Tower is geen uitzondering Nieuw rapport brengt pad naar superieur herstel van aardbevingen in kaart
Nieuw rapport brengt pad naar superieur herstel van aardbevingen in kaart
Hoofdlijnen
- Hoe betrouwbaar zijn schildpadden voor het meten van afval in de oceaan en de gezondheid van de zee?
- Hoeveel biologie -graden zijn er?
- MIT-onderzoeker legt uit hoe ratten denken
- Uit onderzoek blijkt dat mannelijke genen behouden blijven na het verlies van mannetjes bij wandelende takken
- Wie zorgt er bij vogelkoppels voor de kinderen?
- Is er een adjound om het lichaam van tegenovergestelde sekselgender te beschrijven?
- Wat doet de sroutum?
- Waarom cellen schakelen van aerobe naar anaërobe tijdens een race?
- De Middellandse Zee:onvergelijkbare rijkdom in scherpe daling
- Upcycling van plastic afval tot hoogwaardige mechanische smeermiddelen

- Wetenschappers ontrafelen de werkingsprincipes van een veelbelovend materiaal voor het snel opladen van batterijen
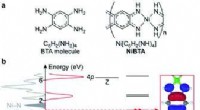
- Studie initieert chemische reacties door materialen te koelen in plaats van ze te verwarmen
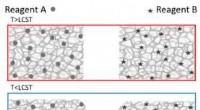
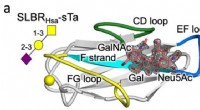
- Gebruikmaken van de structuur van bacteriële gastheercelreceptoren om kanker te detecteren
- Kleine biologisch afbreekbare circuits voor het vrijgeven van pijnstillers in het lichaam

 Musk dagvaardt Twitter-klokkenluider in uitkoopstrijd
Musk dagvaardt Twitter-klokkenluider in uitkoopstrijd Een dwarsgolf zorgt ervoor dat zijn medium in welke richting beweegt?
Een dwarsgolf zorgt ervoor dat zijn medium in welke richting beweegt?  Verkeersveiligheid verbeteren om misdaad aan te pakken
Verkeersveiligheid verbeteren om misdaad aan te pakken Hoe kan een puntmutatie de eiwitsynthese doen stoppen?
Hoe kan een puntmutatie de eiwitsynthese doen stoppen?  Waar wordt zonne -energie gevonden en hoe het is hersteld?
Waar wordt zonne -energie gevonden en hoe het is hersteld?  Vier manieren waarop jij en je bedrijf flexibel werken kunnen verbeteren
Vier manieren waarop jij en je bedrijf flexibel werken kunnen verbeteren Hoe kun je elektrische energie in je huis omzetten?
Hoe kun je elektrische energie in je huis omzetten?  September 2019 even heetste ooit:monitor
September 2019 even heetste ooit:monitor
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

