
Wetenschap
Is CO2 een goede elektrische geleider?
Dit is waarom:
* Moleculaire structuur: CO2 -moleculen zijn niet -polair en hebben een lineaire structuur. Dit betekent dat ze geen vrije elektronen hebben die gemakkelijk kunnen bewegen en een elektrische stroom kunnen dragen.
* binding: De koolstof- en zuurstofatomen in CO2 worden bij elkaar gehouden door sterke covalente bindingen. Deze bindingen zijn zeer stabiel en breken niet gemakkelijk om vrije elektronen vrij te maken.
* isolerende eigenschappen: In feite wordt CO2 in sommige toepassingen vaak gebruikt als isolerend gas vanwege de slechte elektrische geleidbaarheid.
Uitzonderingen:
* Plasma -status: In zijn plasma -toestand (bij extreem hoge temperaturen) kan CO2 geleidend worden. Dit komt omdat de intense warmte de moleculen uit elkaar breekt en vrije elektronen en ionen creëert.
* onzuiverheden: Als CO2 onzuiverheden zoals waterdamp of andere geleidende deeltjes bevat, kan de geleidbaarheid ervan licht toenemen.
Over het algemeen is CO2 onder normale omstandigheden een zeer slechte geleider van elektriciteit.
 Wat zijn enkele voorbeelden van onoplosbare vaste stoffen?
Wat zijn enkele voorbeelden van onoplosbare vaste stoffen?  Wat zijn chemische reacties van feiten?
Wat zijn chemische reacties van feiten?  Hoeveel mol CL -ionen zijn er nodig om volledig te combineren met 0,25 mg 2 -ionen?
Hoeveel mol CL -ionen zijn er nodig om volledig te combineren met 0,25 mg 2 -ionen?  Mag formaldehyde tegenwoordig als ontsmettingsmiddel worden gebruikt?
Mag formaldehyde tegenwoordig als ontsmettingsmiddel worden gebruikt?  Wat is de kleur van de meeste andere metalen elementen?
Wat is de kleur van de meeste andere metalen elementen?
 Kunnen schimmels de grassen van Texas helpen omgaan met de klimaatverandering?
Kunnen schimmels de grassen van Texas helpen omgaan met de klimaatverandering?  De klimaatcrisis is aangebroken - dus stop met je schuldig te voelen en begin je toekomst voor te stellen
De klimaatcrisis is aangebroken - dus stop met je schuldig te voelen en begin je toekomst voor te stellen Hoe de natuurbescherming werkt
Hoe de natuurbescherming werkt  EU stemt in met hervorming van grootste koolstofmarkt ter wereld
EU stemt in met hervorming van grootste koolstofmarkt ter wereld Westerse rivieren krijgen te maken met knijpen als een ander droog jaar vorm krijgt
Westerse rivieren krijgen te maken met knijpen als een ander droog jaar vorm krijgt
Hoofdlijnen
- Hoe maken wetenschappers die verschillende talen spreken hun gegevens begrijpelijk voor elkaar?
- Wat zijn enkele producten gemaakt van varens en hoe zijn ze gevormd?
- Wordt de wetenschappelijke methode gebruikt om kennis te verkrijgen?
- Een laboratoriumtechnicus observeert een eencellulair organisme met twee lange flagella en kernen in het bloeduitstrijkje van persoon. Tot welk phylum hoort deze protozoa thuis?
- Dawn of fishes:vroeg-silurische kaken van gewervelde dieren van kop tot staart onthuld
- Wat is een voorbeeld van Granum?
- Levensduur verlengd door remming van gemeenschappelijk enzym
- Wat is de naam van alle wetenschapper?
- Wat hebben bugs te maken met forensische wetenschap?
- Nieuwe herbruikbare hydrogel kan schoon oogsten, ontzilt water uit vochtige lucht boven zeeoppervlakken

- Fluorescerende sondes om cellulaire activiteit te bestuderen
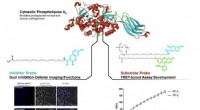
- Oude eiwitten bieden aanwijzingen voor het verleden

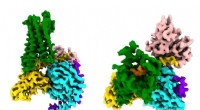
- CryoEM-onderzoek legt opioïde-signalering vast
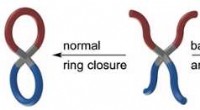
- Chemici synthetiseren moleculaire pretzels
 Wat wordt er geproduceerd als er wrijving ontstaat door kinetische energie?
Wat wordt er geproduceerd als er wrijving ontstaat door kinetische energie?  Wat zou er met sterren gebeuren als er geen zwaartekracht was?
Wat zou er met sterren gebeuren als er geen zwaartekracht was?  Literatuur online:onderzoek naar leesgewoonten bijna in realtime
Literatuur online:onderzoek naar leesgewoonten bijna in realtime Dagelijkse voorbeelden van situaties om kwadratische vergelijkingen toe te passen
Dagelijkse voorbeelden van situaties om kwadratische vergelijkingen toe te passen  Begrijpen en voorbereiden op het bosbrandseizoen
Begrijpen en voorbereiden op het bosbrandseizoen Lasers etsen een perfecte zonne-energieabsorbeerder
Lasers etsen een perfecte zonne-energieabsorbeerder Vrees voor erger wordende overstromingen als moessonregens Zuid-Azië teisteren
Vrees voor erger wordende overstromingen als moessonregens Zuid-Azië teisteren Waarom zijn zonneschermen populair?
Waarom zijn zonneschermen populair?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

