
Wetenschap
Wat zijn chemische reacties van feiten?
wat ze zijn:
* herschikking van atomen: Chemische reacties omvatten het breken en vormen van chemische bindingen tussen atomen. Dit resulteert in de herschikking van atomen om nieuwe stoffen te vormen met verschillende eigenschappen.
* Energie verandert: Chemische reacties omvatten energieveranderingen. Sommige reacties geven energie vrij (exotherme reacties), terwijl anderen energie -input vereisen (endotherme reacties).
* Behoud van massa: In een chemische reactie is de totale massa van de reactanten (uitgangsmaterialen) altijd gelijk aan de totale massa van de producten (gevormde stoffen). Dit staat bekend als de wet van het behoud van massa.
Soorten reacties:
* Synthesereacties: Twee of meer stoffen combineren om een nieuwe stof te vormen. Voorbeeld:2h₂ + o₂ → 2h₂o (vorming van water)
* Ontledingsreacties: Een enkele stof breekt af in twee of meer eenvoudigere stoffen. Voorbeeld:2h₂o → 2h₂ + o₂ (elektrolyse van water)
* Enkele verplaatsingsreacties: Het ene element vervangt een ander element in een verbinding. Voorbeeld:Zn + Cuso₄ → ZnSo₄ + Cu
* Dubbele verplaatsingsreacties: Twee verbindingen wisselen ionen of groepen atomen uit. Voorbeeld:Agno₃ + NaCl → Agcl + nano₃
* verbrandingsreacties: Een stof reageert snel met zuurstof en produceert warmte en licht. Voorbeeld:ch₄ + 2o₂ → co₂ + 2h₂o
* AUTE-BASE-reacties: Een zuur reageert met een basis om zout en water te vormen. Voorbeeld:HCl + NaOH → NaCl + H₂o
factoren die de reactiesnelheid beïnvloeden:
* Temperatuur: Hogere temperaturen verhogen over het algemeen de reactiesnelheden omdat moleculen sneller bewegen, waardoor de frequentie van botsingen wordt verhoogd.
* concentratie: Hogere concentraties reactanten leiden tot meer botsingen, waardoor de reactiesnelheid wordt verhoogd.
* oppervlakte: Het verhogen van het oppervlak van een vaste reactant (bijvoorbeeld door het te slijpen) legt meer moleculen bloot aan botsingen, waardoor de reactie wordt versneld.
* katalysator: Een katalysator versnelt een reactie zonder zichzelf te worden geconsumeerd. Het biedt een alternatieve reactieroute met een lagere activeringsenergie.
Andere belangrijke opmerkingen:
* Omkeerbare reacties: Sommige reacties kunnen in beide richtingen doorgaan.
* evenwicht: Een toestand waar de snelheden van de voorwaartse en omgekeerde reacties gelijk zijn.
* Activeringsenergie: De minimale energie die nodig is voor reactanten om een chemische reactie te starten.
Laat het me weten als je meer wilt weten over een specifiek type chemische reactie of een ander aspect van dit onderwerp!
Hoofdlijnen
- Waar zijn de aanwijzingen voor het maken van een eiwit?
- Welke fasen worden weggelaten in de celcyclus?
- Hoe beïnvloedt een organellenstructuur de functie?
- Waarom moet een persoon met recessief fenotype de munt omdraaien om zijn genotype te bepalen?
- Habitatverlies is de grootste bedreiging voor Australische soorten
- Wat is het verschil tussen continue en discontinue DNA-synthese?
- Opkomende ziekte brengt Noord-Amerikaanse kikkers verder in gevaar
- Wat vermindert ziektekiemen op het oppervlak maar doden ziektekiemen?
- Onderzoekers bepalen hoe type II restrictie-endonuclease Sau3AI DNA splitst
- Onderzoekers produceren biobrandstof voor conventionele dieselmotoren

- Een natuurlijk voorkomende bodembacterie kan een oplossing bieden voor eeuwigdurende chemicaliën
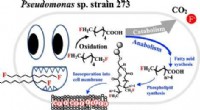
- Een gevaarlijk gif veranderen in een biosensor

- Medische zuurstof mag geen luxe zijn:een goedkopere manier ontwikkelen om het te produceren

- Ontkoppeling van formamidinium–cesium perovskieten voor efficiënte fotovoltaïsche energie
 Orkaan Hector bedreigt Hawaï, John richt zich op Mexico
Orkaan Hector bedreigt Hawaï, John richt zich op Mexico China's oorlog tegen vervuiling laat veelbelovende resultaten zien, studie vondsten
China's oorlog tegen vervuiling laat veelbelovende resultaten zien, studie vondsten Gletsjers in realtime observeren
Gletsjers in realtime observeren Gegevens van de ruimte naar de aarde verzenden met laserfilamenten
Gegevens van de ruimte naar de aarde verzenden met laserfilamenten De fysica van golvend menselijk zwemmen
De fysica van golvend menselijk zwemmen Op weg naar intelligente microrobots
Op weg naar intelligente microrobots Volkswagen staat voor Duitse rechtbank confrontatie over dieselgate
Volkswagen staat voor Duitse rechtbank confrontatie over dieselgate Hoe ‘extracellulaire chaperonnes’ abnormale eiwitten helpen verwijderen
Hoe ‘extracellulaire chaperonnes’ abnormale eiwitten helpen verwijderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


