
Wetenschap
Zou u verwachten dat grotere of kleinere moleculen componenten zijn van een meer viskeuze vloeistof?
* intermoleculaire krachten: Grotere moleculen hebben de neiging om meer oppervlakte te hebben en ervaren dus sterkere intermoleculaire krachten (zoals van der Waals -krachten of waterstofbinding). Deze krachten houden de moleculen dichter bij elkaar, waardoor het moeilijker is om langs elkaar heen te gaan.
* Moleculaire verstrengeling: Grotere moleculen kunnen met elkaar verstrikt raken, waardoor hun weerstand tegen stroming verder wordt vergroot. Stel je voor dat je probeert je een weg te banen door een drukke kamer - hoe meer mensen er zijn, hoe moeilijker het is om te bewegen!
* Verminderd gratis volume: Grotere moleculen nemen meer ruimte in beslag, waardoor minder gratis volume (lege ruimte) tussen hen achterblijft. Dit verminderde vrije volume beperkt het vermogen van de moleculen om vrij te bewegen en draagt bij aan verhoogde viscositeit.
Voorbeelden:
* honing is zeer viskeus vanwege de aanwezigheid van grote suikermoleculen.
* Motorolie is viskeus vanwege de aanwezigheid van grote koolwaterstofketens.
* Water , met zijn kleine moleculen, is veel minder viskeus dan honing of motorolie.
Samenvattend dragen grotere moleculen bij aan hogere viscositeit omdat ze sterkere intermoleculaire krachten ervaren, gemakkelijker verstrikt en minder vrije ruimte voor beweging achterlaten.
 Als de atomen van jodium reageren op het vormen van moleculen stabiliteit zou wat doen wat?
Als de atomen van jodium reageren op het vormen van moleculen stabiliteit zou wat doen wat?  Wat is het verschil tussen H2O2 en H2O?
Wat is het verschil tussen H2O2 en H2O?  Waarom ionische binding energetisch gunstig tussen element van groep 1 2 6 en 7?
Waarom ionische binding energetisch gunstig tussen element van groep 1 2 6 en 7?  Welke actie zal een vaste opgeloste stof langzamer oplossen in vloeibaar oplosmiddel?
Welke actie zal een vaste opgeloste stof langzamer oplossen in vloeibaar oplosmiddel?  Hoeveel equivalenten zitten er in de ionen 1 mol van BR?
Hoeveel equivalenten zitten er in de ionen 1 mol van BR?
 Waarom mogen kinderen niet stemmen? Een deskundige ontkracht de tegenargumenten
Waarom mogen kinderen niet stemmen? Een deskundige ontkracht de tegenargumenten  Klimaatstabilisatie:het planten van bomen kan het terugdringen van de CO2-uitstoot niet vervangen
Klimaatstabilisatie:het planten van bomen kan het terugdringen van de CO2-uitstoot niet vervangen Breedbladige bomen vertonen een verminderde gevoeligheid voor het broeikaseffect
Breedbladige bomen vertonen een verminderde gevoeligheid voor het broeikaseffect  Klimaatpatronen in de noordelijke Stille Oceaan beïnvloeden het optreden van El Niño
Klimaatpatronen in de noordelijke Stille Oceaan beïnvloeden het optreden van El Niño Vulkaan barst uit op Spaanse Canarische Eilanden
Vulkaan barst uit op Spaanse Canarische Eilanden
Hoofdlijnen
- Doodt ontvetter of desinfectiemiddel bacteriën?
- Wat is dominant en recessief?
- Wat doodde tonnen vissen in de Europese rivier? Het mysterie wordt dieper
- Een vrouw heeft twee dominante allelen. Wat is haar fenotype?
- Wat is het masker van Anubis?
- Wat zijn de structuur en functie van eiwitten?
- Waarom worden sommige mensen honderd? Darmbacteriën kunnen het antwoord bevatten
- Welk macromolecuul is geslachtshormonen?
- Welk spiercel -eiwit werkt als een ATPase -enzym?
- Nieuwe core-shell-katalysator voor ethanolbrandstofcellen
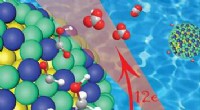
- De energie-implicaties van organische radicaalpolymeren

- Honingraatstructuur met zuurstofarme poriën gevonden in oxideschaal op kleine, op lood gebaseerde reactormaterialen

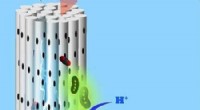
- Nuttige microben inhaleren koolstofdioxide via een poreuze cilindrische elektrode en scheiden nuttige chemicaliën uit
- lasers, levitatie en machine learning maken betere hittebestendige materialen

 Californië verbiedt de zalmvisserij voor het seizoen in de rivieren in het Sacramento-gebied en het Klamath-bekken
Californië verbiedt de zalmvisserij voor het seizoen in de rivieren in het Sacramento-gebied en het Klamath-bekken  Onderzoekers onderzoeken de eigenaardige radiobron IC 1531
Onderzoekers onderzoeken de eigenaardige radiobron IC 1531 Wat biedt de warmte die nodig is om een metamorfe rots te vormen?
Wat biedt de warmte die nodig is om een metamorfe rots te vormen?  Wat was het doel van Astrolabe?
Wat was het doel van Astrolabe?  Wat is de gemiddelde bindingsenthalpie van stikstof?
Wat is de gemiddelde bindingsenthalpie van stikstof?  Flippers en fluiten:hoe muziek ons helpt met dolfijnen te praten
Flippers en fluiten:hoe muziek ons helpt met dolfijnen te praten  De alkaliteit in een zoetwateraquarium verhogen
De alkaliteit in een zoetwateraquarium verhogen Wat is het type afwijking waarin een erosie -oppervlak een verschillende horizontale lagen bestaat?
Wat is het type afwijking waarin een erosie -oppervlak een verschillende horizontale lagen bestaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

