
Wetenschap
Waar houdt zwavel graag mee?
meest voorkomende bindingspartners:
* zuurstof (O): Zwavel vormt gemakkelijk sterke bindingen met zuurstof, wat leidt tot de vorming van sulfaten (So₄²⁻), sulfieten (SO₃²⁻) en zwaveloxiden (SO₂ en SO₃). Deze verbindingen zijn cruciaal in verschillende industriële processen, zure regenvorming en zelfs biologische processen zoals ademhaling.
* waterstof (h): Zwavel vormt waterstofsulfide (H₂s), een fout geurgas dat verantwoordelijk is voor de "rotte ei" geur. Het neemt ook deel aan de vorming van thiolen (R-SH), organische verbindingen met zwavelhydrogen bindingen, die een belangrijke rol spelen in verschillende biologische processen.
* koolstof (c): Zwavel vormt een breed scala aan organische verbindingen met koolstof, waaronder thiolen, sulfiden (R-S-R), disulfiden (R-S-S-R) en sulfonzuren (R-SO₃H). Deze verbindingen zijn te vinden in verschillende natuurlijke producten, geneesmiddelen en industriële materialen.
Andere bindingspartners:
* metalen: Zwavel bindt gemakkelijk met metalen om sulfiden te vormen. Deze verbindingen worden vaak aangetroffen in mineralen, zoals ijzeren pyriet (FES₂). Veel metalen sulfiden zijn belangrijke bronnen van metalen.
* halogenen: Zwavel kan bindingen vormen met halogenen zoals chloor (CL) en fluor (F), waardoor verbindingen zoals zwavellchloride (SO₂cl₂) en zwaveldhexafluoride (SF₆) worden geproduceerd.
factoren die binding beïnvloeden:
* elektronegativiteit: Door de matige elektronegativiteit van Sulphur kan het zowel ionische als covalente bindingen vormen.
* valentie -elektronen: Zwavel heeft zes valentie -elektronen, waardoor het tot twee dubbele bindingen of meerdere enkele bindingen kan vormen.
* Oxidatie stelt: Zwavel kan verschillende oxidatietoestanden vertonen, van -2 tot +6, die het bindgedrag ervan beïnvloeden.
Belangrijke overwegingen:
* stabiliteit: De bindingsvoorkeuren van Sulphur worden sterk beïnvloed door het bereiken van stabiliteit. Het vormt er de voorkeur aan bindingen te vormen die resulteren in een volledig octet van elektronen in zijn buitenste schaal.
* Reactiviteit: Zwavel kan zeer reactief zijn, vooral in aanwezigheid van zuurstof of warmte. Deze reactiviteit wordt in verschillende industriële processen gebruikt.
Het diverse bindgedrag van Sulphur maakt het een cruciaal element in een breed scala van toepassingen, van energieproductie en productie tot biologische processen en geneeskunde.
 Onderzoeken waarom planten vroeg bloeien in een opwarmende wereld
Onderzoeken waarom planten vroeg bloeien in een opwarmende wereld  Wat is een andere naam voor een semi -aride klimaat?
Wat is een andere naam voor een semi -aride klimaat?  Welke fysieke verandering zou een plant waarschijnlijk helpen zich aan te passen aan het leven in een gebied met weinig regenval?
Welke fysieke verandering zou een plant waarschijnlijk helpen zich aan te passen aan het leven in een gebied met weinig regenval?  COVID-19-crisis veroorzaakt 17% daling van de wereldwijde CO2-uitstoot:studie
COVID-19-crisis veroorzaakt 17% daling van de wereldwijde CO2-uitstoot:studie Arctic kan geconfronteerd worden met een nieuwe verzengende annus horribilis
Arctic kan geconfronteerd worden met een nieuwe verzengende annus horribilis
Hoofdlijnen
- Genetisch onderzoek toont aan dat vissen in de vroege zomer een evolutionaire impact kan hebben, wat resulteert in kleinere zalm
- Welke planten moeten gezond groeien?
- Groenlandse walvissen komen naar Cumberland Sound in Nunavut om te exfoliëren
- Welke vorm gebruiken mensen koolhydraten?
- Welk deel van een dierencel fungeert als de cel van de hersenen of de controlecentrum?
- Hoe verwerf je aangeboren gedrag?
- Wat zijn de functies van Triglyceride Phospholipid & Sterol?
- Wetenschapper roept publiek op om genen van bedreigde vleermuissoorten te ontsluiten
- Wetenschappers vinden bewijs voor alternatieve theorieën over hoe het leven is ontstaan
- Voor altijd vechten tegen chemicaliën met microben

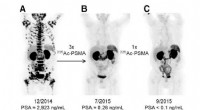
- Hoe wetenschappers een nieuwe manier ontdekten om actinium-225 te produceren, een zeldzame medische radio-isotoop
- Hoe optische pincetten een van de grootste uitdagingen van misdaadlabs kunnen aanpakken

- Nieuwe superlijm maakt het mogelijk om rekbare hydrogels te verlijmen

- Snelle detectie van uraniumisotopen helpt bij het beschermen van nucleair materiaal

 Teken het elektronenstipdiagram dat kalium laat zien dat een chemische binding met broom vormt?
Teken het elektronenstipdiagram dat kalium laat zien dat een chemische binding met broom vormt?  Vrouwelijke gedetineerden die gevangenisstraffen uitzitten met hun baby's hebben significant minder kans op recidive
Vrouwelijke gedetineerden die gevangenisstraffen uitzitten met hun baby's hebben significant minder kans op recidive Wat gebeurt er met de luchttemperatuur van een dalende massa -lucht?
Wat gebeurt er met de luchttemperatuur van een dalende massa -lucht?  Zout is een voorbeeld van een stof?
Zout is een voorbeeld van een stof?  Waarom is babypoeder ontvlambaar?
Waarom is babypoeder ontvlambaar?  Hoe is de wetenschap betrokken bij katapulten?
Hoe is de wetenschap betrokken bij katapulten?  In welk pad kan elektriciteit erin reizen?
In welk pad kan elektriciteit erin reizen?  Hoe wordt potentische energie genoemd die afhankelijk is van hoogte?
Hoe wordt potentische energie genoemd die afhankelijk is van hoogte?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

