
Wetenschap
Teken het elektronenstipdiagram dat kalium laat zien dat een chemische binding met broom vormt?
1. Bepaal de valentie -elektronen
* kalium (k): Groep 1, dus het heeft 1 valentie -elektron.
* Bromine (Br): Groep 17, dus het heeft 7 valentie -elektronen.
2. Vertegenwoordigen de atomen
* Gebruik het elementsymbool (K en BR) om de atomen weer te geven.
* Plaats stippen rond het symbool om de valentie -elektronen weer te geven. Vergeet niet om de heerschappij van Hund te volgen (elk orbitaal krijgt één elektron voor het koppelen).
3. Toon de overdracht van elektronen
* Kalium (K) verliest zijn ene valentie -elektron om een positief geladen ion (k+) te worden.
* Bromine (BR) zal één elektron krijgen om een negatief geladen ion te worden (Br-).
4. Teken de uiteindelijke structuur
* Toon de ionen naast elkaar, met de elektronenoverdracht aangegeven door een pijl.
Hier is het laatste diagram:
`` `
.
K. → Br:
.
. . .
`` `
Verklaring:
* De pijl toont het elektron dat van het kaliumatoom naar het broomatoom beweegt.
* De resulterende ionen (k+ en br-) hebben nu een complete buitenste schaal, waardoor ze stabieler worden.
* De elektrostatische aantrekkingskracht tussen de tegengesteld geladen ionen vormt de ionische binding.
Hoofdlijnen
- Wat is de theorie van overerving dat genen zich bevinden op chromosomen die segregatie en onafhankelijk assortiment ondergaan?
- Welke organel in een plant laat glucose uit zonlicht komen?
- Welke Arer Carnivor?
- Wat eet een milkweed -plant?
- Waarom de hersenontwikkeling van een kleine worm licht zou kunnen werpen op het menselijk denken
- Structuur van het hart Cell
- Onderzoek toont aan dat cabernet-druiven klimaatverandering kunnen overleven
- Welke structuur leidt de activiteiten van een cel?
- Wat is een eigenschap die het resultaat is van twee dominante genen?
- Machine learning gebruiken om veelbelovende polymeermembranen te identificeren

- Neutronen maken structurele veranderingen in moleculaire borstels zichtbaar

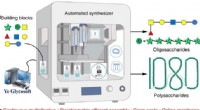
- Geautomatiseerde koolhydraatsynthesizer produceert polysachariden met een recordlengte
- Unieke ferro-elektrische microstructuur voor het eerst onthuld

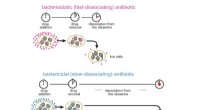
- Antibiotica leren om effectievere moordenaars te zijn
 Wat is het denkbeeldige pad dat elke planeet rond de zon volgt?
Wat is het denkbeeldige pad dat elke planeet rond de zon volgt?  Eerste tweedimensionaal materiaal dat zowel als topologische isolator als als supergeleider fungeert
Eerste tweedimensionaal materiaal dat zowel als topologische isolator als als supergeleider fungeert Paramecium is een eencellige consument Welke functies moet het uitvoeren dat multicellular niet zou uitkomen?
Paramecium is een eencellige consument Welke functies moet het uitvoeren dat multicellular niet zou uitkomen?  Hoe trauma door sekshandel de manier beïnvloedt waarop de overlevenden ouder worden
Hoe trauma door sekshandel de manier beïnvloedt waarop de overlevenden ouder worden  Wetenschappers identificeren hoe onschadelijke darmbacteriën 'slecht worden'
Wetenschappers identificeren hoe onschadelijke darmbacteriën 'slecht worden'  Gebruikt een magnetron warmte -energie?
Gebruikt een magnetron warmte -energie?  Hoe verschilt de stroom van elektriciteit in een batterij van het type type stroom?
Hoe verschilt de stroom van elektriciteit in een batterij van het type type stroom?  Wat is een goed idee voor een essay over het vergelijken en contrasteren van twee dingen in uw zonnestelsel?
Wat is een goed idee voor een essay over het vergelijken en contrasteren van twee dingen in uw zonnestelsel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


