
Wetenschap
Hoeveel waterstofatomen zijn er in 1 kg?
* waterstof is een element: Het bestaat als individuele atomen (H), maar vormt ook moleculen zoals diatomaire waterstof (H₂) en verbindingen zoals water (H₂o).
* massa en aantal atomen: De massa van een stof is afhankelijk van het aantal atomen * en * het type aanwezige atomen.
Hier is hoe u dit probleem kunt benaderen:
1. Geef de stof op: Vraagt u naar pure waterstof (H₂), water (h₂o) of iets anders?
2. Bereken mol: Gebruik de molaire massa van de stof om 1 kg om te zetten in mol.
* De molaire massa van H₂ is bijvoorbeeld 2 g/mol. Dus 1 kg (1000 g) H₂ is 1000 g / 2 g / mol =500 mol.
3. Gebruik Avogadro's nummer: Eén mol van elke stof bevat 6,022 x 10²³ deeltjes (atomen, moleculen, enz.).
* In ons H₂ -voorbeeld bevatten 500 mol H₂ 500 mol * 6.022 x 10²³ Moleculen/mol =3,011 x 10²⁶ moleculen van H₂.
4. Laad voor waterstofatomen per molecuul: Aangezien elk H₂ -molecuul twee waterstofatomen heeft, vermenigvuldigt u het aantal moleculen met 2:3.011 x 10²⁶ moleculen * 2 atomen/molecuul =6,022 x 10²⁶ waterstofatomen.
Samenvattend:
* voor 1 kg zuivere waterstof (H₂): Er zijn ongeveer 6,022 x 10²⁶ waterstofatomen.
* voor andere stoffen: Het aantal waterstofatomen zal verschillen, afhankelijk van de chemische formule en molaire massa van de stof.
 'Wij concluderen' of 'ik geloof?' Uit onderzoek blijkt dat de rationaliteit tientallen jaren geleden is afgenomen
'Wij concluderen' of 'ik geloof?' Uit onderzoek blijkt dat de rationaliteit tientallen jaren geleden is afgenomen  Klimaatverandering biedt Engelse wijnmakers sprankelende vooruitzichten
Klimaatverandering biedt Engelse wijnmakers sprankelende vooruitzichten Wat is de impact van beschavingen op de omgeving van de aarde?
Wat is de impact van beschavingen op de omgeving van de aarde?  Een miljoen jaar zonder megaslide:onderzoek gaat diep de Golf van Alaska in om te onderzoeken waarom
Een miljoen jaar zonder megaslide:onderzoek gaat diep de Golf van Alaska in om te onderzoeken waarom  Hoe iBuyers de raciale ongelijkheid in onroerend goed en het aantal individuele huizenbezit in één grote stad veranderen
Hoe iBuyers de raciale ongelijkheid in onroerend goed en het aantal individuele huizenbezit in één grote stad veranderen
Hoofdlijnen
- Welke parasiet wordt vaak overgedragen van dieren op mensen door contact met vervuilde ontlasting?
- Leeft de buff-breasted button-kwartel nog? Dit eeuwenoude vogelmysterie moet nog worden opgelost
- EU-handelsverbod verlaagt wereldhandel in wilde vogels met 90 procent
- Hoe kan embryonale ontwikkeling worden gebruikt als bewijs voor evolutie?
- Nugget the cow:Zeewier-kauwend rund kauwt op oplossing voor methaanprobleem
- Uit nieuw onderzoek blijkt dat bioluminescentie vaker voorkomt dan eerder werd gedacht bij diepzeegarnalen
- Amerikaanse melkkoeien vormen het topje van de ijsberg nu de vogelgriep zich wereldwijd onder zoogdieren verspreidt, zegt ecoloog
- Maleisië omarmt het werk van Melanies aan de illegale handel in wilde dieren
- Waarom zijn genen belangrijk tijdens plantengroei?
- Het stimuleren van chemische reacties in vaste toestand
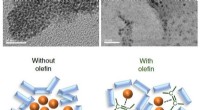
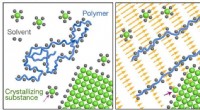
- Verbetering van de kristalgroei met behulp van polyelektrolytoplossingen en afschuifstroming
- Katoen maken dat brandveilig en comfortabel is

- Wetenschappers verbeteren het proces om moeilijk te recyclen plastic afval om te zetten in brandstof

- Goedkopere waterstofbrandstofcel kan betere groene energie-opties betekenen

 Gentrificatie zorgt voor een daling van 16 procent in stadscriminaliteit in Cambridge, Massachusetts
Gentrificatie zorgt voor een daling van 16 procent in stadscriminaliteit in Cambridge, Massachusetts Kleine lichtbak opent nieuwe deuren naar de nanowereld
Kleine lichtbak opent nieuwe deuren naar de nanowereld Welk chemisch symbool vertegenwoordigt een metaalelement?
Welk chemisch symbool vertegenwoordigt een metaalelement?  Quantum dots volgen wie in de celkern komt
Quantum dots volgen wie in de celkern komt Transgender Amerikanen zijn vaker werkloos en arm
Transgender Amerikanen zijn vaker werkloos en arm Welke ionen zijn er in calciumchloride?
Welke ionen zijn er in calciumchloride?  Zwarte zomerbranden in Australië hebben de ozonlaag aangetast:studie
Zwarte zomerbranden in Australië hebben de ozonlaag aangetast:studie Top 5 oude Inca-uitvindingen
Top 5 oude Inca-uitvindingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

