
Wetenschap
Wat hebben een beryllium -ion en neonatoom gemeen?
* Ze hebben allebei hetzelfde aantal elektronen: Zowel be²⁺ als NE hebben 2 elektronen. Beryllium heeft 4 elektronen in zijn neutrale toestand, maar verliest er twee wanneer het de ionen be²⁺ vormt.
* Ze hebben dezelfde elektronenconfiguratie: Zowel be²⁺ als NE hebben de elektronenconfiguratie 1S². Dit betekent dat hun elektronen op dezelfde manier zijn gerangschikt.
* Ze zijn allebei chemisch stabiel: Vanwege hun volledige elektronenschalen zijn zowel BE²⁺ als NE zeer stabiel en niet -reactief. Ze worden beschouwd als edelgasconfiguraties.
Hoewel ze deze kenmerken delen, onderscheiden ze ook van elkaar:
* Verschillende aantal protonen: Beryllium (BE) heeft 4 protonen, terwijl neon (NE) 10 protonen heeft. Dit betekent dat ze verschillende atoomnummers hebben en verschillende elementen zijn.
* Verschillende maat: Be²⁺ is kleiner dan NE omdat het minder elektronen heeft en een grotere nucleaire lading.
Hoewel ze vergelijkbaar zijn in termen van elektronenconfiguratie en stabiliteit, zijn ze nog steeds fundamenteel verschillende elementen vanwege hun verschillende aantallen protonen.
 Fukushima:Waarom we duizenden jaren terug moeten kijken om beter te worden in het voorspellen van aardbevingen
Fukushima:Waarom we duizenden jaren terug moeten kijken om beter te worden in het voorspellen van aardbevingen Wat is een andere Engelse naam voor de Peepal Tree?
Wat is een andere Engelse naam voor de Peepal Tree?  Vraag en antwoord:Expert bespreekt het milieubeleid van de regering van Bolsonaro
Vraag en antwoord:Expert bespreekt het milieubeleid van de regering van Bolsonaro Een (veel) eerdere geboortedatum voor tektonische platen
Een (veel) eerdere geboortedatum voor tektonische platen Egg Drop School Projects
Egg Drop School Projects
Hoofdlijnen
- Vier hoofdgroepen organische verbindingen waaruit levende organismen bestaan
- Wat is het principe van dominantie en recessiviteit?
- Welk hormoon regelt niet direct menselijke reproductieve cycli?
- Bereken de percentages van adenine in een DNA-streng
- Hoe verschillen de vier soort DNA -nucleotiden van elkaar?
- Uit onderzoek blijkt dat door klimaatverandering hommels eerder uit de winterslaap komen, waardoor de soort gevaar loopt
- Wat zijn de verschillen tussen heterozygote en homozyguizend hoe recessieve allels te domineren, spelen er een rol in?
- Wat is direct bewijs in de wetenschap?
- Welke 4 dingen hebben cellen in Commmon?
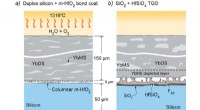
- Materiaal en coatingproces om keramische onderdelen te beschermen
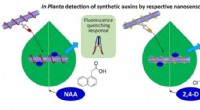
- Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren
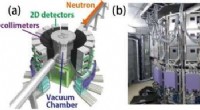
- Apatietachtige materialen zonder interstitiële zuurstofverbindingen vertonen een hoge oxide-ionengeleiding door overbinding
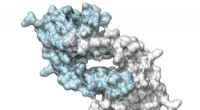
- Designer-enzym gebruikt onnatuurlijk aminozuur voor katalyse
- Nieuwe sensor meet calciumconcentraties diep in weefsel

 De combinatie van alle krachten die op een object handelen?
De combinatie van alle krachten die op een object handelen?  Wat is de fysieke toestand van asthenosfeer?
Wat is de fysieke toestand van asthenosfeer?  Grondwaterinformatie is niet langer uit de diepte
Grondwaterinformatie is niet langer uit de diepte Oude botten onthullen twee walvissoorten die verloren zijn gegaan uit de Middellandse Zee
Oude botten onthullen twee walvissoorten die verloren zijn gegaan uit de Middellandse Zee Conservering verborgen kosten nemen een hap uit de baten
Conservering verborgen kosten nemen een hap uit de baten Het verschil tussen diagrammen en grafieken
Het verschil tussen diagrammen en grafieken Voert een vrij vallend object een krachtenbalans ervaart?
Voert een vrij vallend object een krachtenbalans ervaart?  Hoe hebben wetenschappers vastgesteld dat de aarde jaren geleden 4.567 Billon werd gemaakt?
Hoe hebben wetenschappers vastgesteld dat de aarde jaren geleden 4.567 Billon werd gemaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

