
Wetenschap
Naar welke elementen houdt magnesium vast om te binden?
1. Niet -metalen: Magnesium heeft een sterke affiniteit voor niet -metalen, vooral die met een hoge elektronegativiteit. Dit resulteert in ionische bindingen:
* zuurstof (O): Magnesium vormt magnesiumoxide (MGO), een gemeenschappelijke verbinding die wordt gevonden in de korst van de aarde.
* halogenen (F, CL, Br, I): Magnesium reageert gemakkelijk met halogenen om haliden zoals magnesiumchloride (MGCL2) te vormen, gebruikt in verschillende industriële toepassingen.
* stikstof (n): Hoewel minder gebruikelijk, kan magnesium reageren met stikstof om magnesiumnitride te vormen (Mg3n2).
* fosforus (P): Magnesium reageert met fosfor om magnesiumfosfide te vormen (mg3p2).
2. Andere metalen: Magnesium kan legeringen vormen met andere metalen, waardoor materialen met gewenste eigenschappen worden gecreëerd:
* aluminium (AL): Magnesium-aluminiumlegeringen zijn lichtgewicht en sterk, gebruikt in ruimtevaart- en automobieltoepassingen.
* zink (Zn): Magnesium-zinklegeringen worden gebruikt bij het gieten en andere productieprocessen.
3. Koolstof (c): Hoewel het geen traditionele ionische bindingen vormt, kan magnesium reageren met koolstof om organomagnesiumverbindingen te vormen, die essentieel zijn bij organische chemische reacties (bijv. Grignard -reagentia).
Sleutelpunten:
* elektropositiviteit: Magnesium is zeer elektropositief, wat betekent dat het gemakkelijk elektronen verliest om een stabiele elektronenconfiguratie te bereiken.
* ionische binding: Het grootste deel van de binding met magnesium is ionisch, waarbij het elektronen overbrengt naar niet -metalen.
* Reactiviteit: De reactiviteit van Magnesium is een sleutelfactor in zijn diverse bindingsmogelijkheden.
Laat het me weten als je meer details wilt over specifieke verbindingen of bindtypen met magnesium!
 Is nitreus een zuur of basis?
Is nitreus een zuur of basis?  Wat is de vergelijking voor appelzuur en natriumhydroxide?
Wat is de vergelijking voor appelzuur en natriumhydroxide?  Wat bevat het laden van kleurstof?
Wat bevat het laden van kleurstof?  Hoe kan een chemische vergelijking van natriumfosfaat die reageert met calciumnitraat om te produceren en gebalanceerd te worden?
Hoe kan een chemische vergelijking van natriumfosfaat die reageert met calciumnitraat om te produceren en gebalanceerd te worden?  Wat betekent het als bekend is dat de ene substantie een betere geleider van warmte is dan de andere?
Wat betekent het als bekend is dat de ene substantie een betere geleider van warmte is dan de andere?
 geloof leiders, Pygmeeën bundelen krachten in strijd om Congobos
geloof leiders, Pygmeeën bundelen krachten in strijd om Congobos Broeikasgassen doen de stratosfeer krimpen
Broeikasgassen doen de stratosfeer krimpen Bergleeuw! Staan of rennen?
Bergleeuw! Staan of rennen?  Nieuwe methode helpt bij het detecteren van biocontaminanten die gemakkelijk in water worden overgedragen en in de industrie worden gebruikt
Nieuwe methode helpt bij het detecteren van biocontaminanten die gemakkelijk in water worden overgedragen en in de industrie worden gebruikt Opwarming van het noordpoolgebied is nieuw normaal, zal ons allemaal raken:rapporteren (update 2)
Opwarming van het noordpoolgebied is nieuw normaal, zal ons allemaal raken:rapporteren (update 2)
Hoofdlijnen
- Hoe zijn de hersenen van primaten zo groot geworden?
- Boomwoning, kokosnootkrakende gigantische rat ontdekt op de Salomonseilanden
- Nieuwe hypothese legt uit hoe menselijke voorouders vuur in hun voordeel gebruikten
- Sour Patch-volwassenen:1 op de 8 volwassenen houdt van extreme zuurheid, blijkt uit onderzoek
- Welke vaardigheden krijg je van de wetenschap?
- Tsjaad breidt belangrijk natuurgebied in nationaal park uit
- Wat is een voorbeeld in een levend systeem van hoe moleculair van vorm is?
- Wat is een sequencing-connectief?
- 520 miljoen jaar oud wormfossiel lost het mysterie op van hoe moderne insecten, spinnen en krabben zijn geëvolueerd
- Duurzaam biomedisch hulpmiddel voor gebruik in regeneratieve geneeskunde

- Om de peilstokdiagnose en omgevingstests te verbeteren, voeg gewoon tape toe

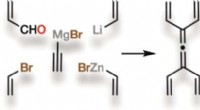
- Gespannen, symmetrisch, en nieuw:tetravinylalleen, een klein maar krachtig molecuul, is voor het eerst gesynthetiseerd
- Out of the blue:Middeleeuwse fragmenten leveren verrassingen op

- Water beïnvloedt de plakkerigheid van hyaluronan

 Hoe slecht zijn invasieve planten voor vogels? Uit onderzoek blijkt dat grootschalige verwijdering mogelijk geen beoogde voordelen heeft
Hoe slecht zijn invasieve planten voor vogels? Uit onderzoek blijkt dat grootschalige verwijdering mogelijk geen beoogde voordelen heeft  Zou het leven in een klomp ijs kunnen zijn begonnen?
Zou het leven in een klomp ijs kunnen zijn begonnen?  Groep werkt aan het bedenken van topologische supergeleider
Groep werkt aan het bedenken van topologische supergeleider Waarom is een gematigd regenwoud een open systeem?
Waarom is een gematigd regenwoud een open systeem?  Kwantumcontrole voor geavanceerde technologie:verleden en heden
Kwantumcontrole voor geavanceerde technologie:verleden en heden Wat is de beweging waarin Mars de normale richting van de hemel leek om te keren?
Wat is de beweging waarin Mars de normale richting van de hemel leek om te keren?  Wat zijn de overeenkomsten van suikerkorrels Watersteenlucht in balbladeren in de bal?
Wat zijn de overeenkomsten van suikerkorrels Watersteenlucht in balbladeren in de bal?  Wat gebeurt er met zwavel bij de elektrolyse van koper-2-sulfaat?
Wat gebeurt er met zwavel bij de elektrolyse van koper-2-sulfaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

